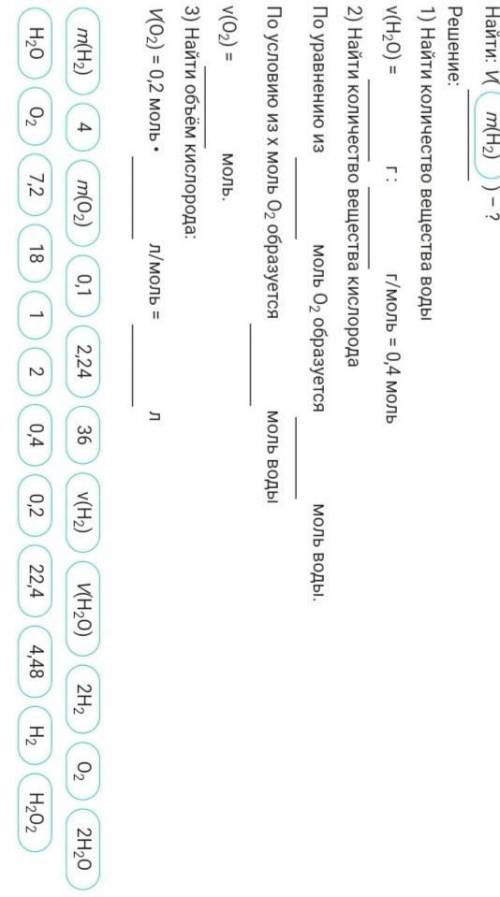
Восстановите условия задачи и ее решение. При взаимодействии кислорода с водорода образовалось 7,2 г воды.Определите необходимый объем кислорода при н.у.
Другие вопросы по теме Химия
Популярные вопросы
- 1.Каким документом оформляют в кассе подотчет.2.В каком документе нет...
3 - Рецензия на роман Бориса Акунина «Азазель». 4. Разбор произведения:...
1 - 1) Найти наибольшую сторону прямоугольника площадью равной 24, если...
3 - ответить на во да или нет.1.Алюминий – металл побочной подгруппы.2.При...
2 - решить задания ОГЭ На сколько процентов площадь спальни (без лоджии)...
3 - Дана правильная треугольная пирамида со стороной 6 см и высотой боковой...
2 - Решите неравенство:1) x−7/x+8 ≤ 02) (8−x)/x−4 ≤ 03) (x+1)(4+5)/x+6/...
1 - Відносна густина газу за гелієм становить 27. Встанови відносну густину...
1 - Найти абсциссы точек пересечения графиков функций y=sin2x y=3sinx...
2 - Тест Кінематика решить Во стоят не по порядку....
3
Для решения задачи нужно знать, что вода (H2O) образуется при реакции взаимодействия кислорода (O2) с водородом (H2) по следующему уравнению реакции:
2H2 + O2 → 2H2O
Из уравнения видно, что для образования 2 молекул воды требуется одна молекула кислорода. Таким образом, массовая доля кислорода в воде будет равна 32/18 = 1,78 г/г.
Теперь посчитаем, сколько граммов кислорода содержится в 7,2 г воды:
Массовая доля кислорода в воде = 1,78 г/г
Масса кислорода в воде = Массовая доля кислорода в воде × масса воды
Массовая доля кислорода в воде = 1,78 г/г
Масса кислорода в воде = 1,78 г/г × 7,2 г = 12,816 г
Теперь, чтобы найти объем кислорода при нормальных условиях (н.у.), воспользуемся уравнением Клапейрона:
pV = nRT
где p - давление газа, V - его объем, n - количество вещества, R - универсальная газовая постоянная, T - температура газа.
Для кислорода при нормальных условиях давление составляет 1 атмосферу, и температура равна 273,15 К (0 °C). Также, зная молярную массу кислорода (32 г/моль), мы можем найти количество вещества кислорода:
Масса кислорода = количество вещества кислорода × молярную массу кислорода
количество вещества кислорода = Масса кислорода / молярная масса кислорода
количество вещества кислорода = 12,816 г / 32 г/моль = 0,40 моль
Теперь мы можем найти объем кислорода при нормальных условиях, используя уравнение Клапейрона:
pV = nRT
V = (nRT) / p
V = (0,40 моль × 0,0821 атм·л/моль·К × 273,15 К) / 1 атм
V ≈ 8,50 л
Таким образом, необходимый объем кислорода при нормальных условиях составляет примерно 8,50 л.