Найдите массу 20 процентной соляной кислоты необходимой для реакции с 160 г 20 процентного раствора гидроксида натрия
Другие вопросы по теме Химия
Популярные вопросы
- Почему одни организмы растут медленно, а другие быстро ?...
3 - Уиры 2 дм тесьмы хватит ли его чтобы обшить карман квадратной формы...
1 - безденежье - фонетический разбор , разобрать слово по составу...
2 - Над светлым озером пурпуровой зари вечерней пламень потухает.окончания...
2 - Начертите (любой треугольник) и опишите его окружности....
2 - Найдите значение функции 3t+2 6t-1 если t=1 3...
1 - Найти правила концентрированого и разбавленого hno3 с металами...
3 - ответь what is the most famous london tower варианты ответов: 1)hyde...
1 - Берілген сөзге фонетиқалық талдау жаса: тəрбие...
3 - Написать программу на языке pascal для вычисления n-ой степени...
2
Потребуется 146 г 20%-ной соляной кислоты.
Объяснение:
По уравнению реакции соляная кислота и гидроксид натрия реагируют в отношении 1 моль : 1 моль.
HCl + NaOH → NaCl + H₂O
Найдем количество вещества гидроксида натрия в 160 г 20%-ного раствора.
Масса гидроксида натрия в растворе: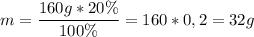 ;
;
Молярная масса M(NaOH) = 23 + 16 + 1 = 40 г/моль
Количество вещества: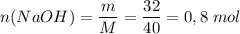
В реакцию вступило 0,8 моль гидроксида натрия и 0,8 моль соляной кислоты. Найдем массу соляной кислоты.
Молярная масса M(HCl) = 1 + 35,5 = 36,5 г/моль
Масса m(HCl) = n*M = 0,8 моль * 36,5 г/моль = 29,2 г.
⇒ В 20%-ном растворе соляной кислоты содержится 29,2 г чистого вещества HCl.
Найдем массу раствора соляной кислоты: