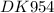Вычислите тепловой эффект процесса, H298 (кДж), протекающего в стандартных условиях, для следующих реакций: 3CuO(тв) + 2Fe(тв) = 3Cu(тв) + Fe2O3(тв)
Другие вопросы по теме Химия
Популярные вопросы
- Разбери по составу под березкой белеет пушистый ландыш...
3 - Решите . двум классам поручено расчистить школьный каток длина которого 20м а ширига...
2 - 13 подвиг геракла цитатами из текста ответить: 1) возраст 2)образование,любимое...
2 - Сделайте разбор морфологический(не по ) слов почему-то, всегда...
3 - Дан прямоугольный равнобедренный треугольник авс. определите, какая получится фигура...
1 - За 3,5м. ткани заплатили 577,5 р. какова стоимость 20,25 м. этой ткани решите...
1 - Стоимость 6 одинаковых по цене шоколадок 24 рубля. сколько денег нужно заплатить...
1 - Духовний світ євгенія онєгіна твір на українськом, потрібно дуже буду вдячна)...
1 - Вмультфильме чертенок n13 был девиз : люби себя,чихай на всех,и в жизни ждет тебя...
1 - Какого цвета был слон из надиной мечты? игрушечного слона она увидела серым, а живого?...
2
1) Для начала мы запишем уравнение реакций из условия задачи:
3CuO(тв.) + 2Fe(тв.)→ 3Cu(тв.) + Fe₂O₃(тв.)
2) Далее мы запишем энтальпию веществ из условия реакций:
ΔH°(CuO) = -162 кДж
ΔH°(Fe) = 0 кДж
ΔH°(Cu) = 0 кДж
ΔH°(Fe₂O₃) = -822,2 кДж
3) Далее мы находим тепловой эффект процесса реакций:
ΔH₂₉₈ = ∑Hпр.р - ∑Hисх.в-в. = (3ΔH°(Cu) + ΔH°(Fe₂O₃)) - (3ΔH°(CuO) + ΔH°(Fe)) = (3×0 кДж + (-822,2 кДж)) - (3×(-162 кДж) + 2×0 кДж) = (0 кДж - 822,2 кДж) - ((-486 кДж) + 0 кДж) = -822,2 кДж - (-486 кДж) = -822,2 кДж + 486 кДж = -336,2 кДж
ответ: ΔH₂₉₈ = -336,2 кДж
Решено от :