Вычислить массу (г) 750 мл углекислого газа при температуре 42°с и давлении 93 кпа.
Другие вопросы по теме Химия
Популярные вопросы
- Завдання 1 Спираючись на знання про чинники впливу на швидкість хімічної...
1 - Результати дисидентського руху для кожного з учасників й для суспільства...
3 - В каких из представленных примеров магнитное поле можно считать однородным?...
1 - Художественные особенности трагедии Моцарт и Сальери ...
1 - Решите задачу: Ребята заполнили водой два больших аквариума, в один...
1 - Решите уравнение 8 − х − 3(2 − 5х) = 14 + 8х. ответ: х=___...
1 - 2. The sun ... when we came to the river. A) shoneB) was shiningC)...
2 - 1. Почему для Паустовского так важно точное указание времени года,...
3 - ответить на вопрос по белоруской летературе номер 3...
2 - Дополни предложения. 1. Первые наземные растения появились на Земле...
1
Вычислите массу углекислого газа при температуре 25 С и давлением 350кПа, если его обьем составляет 100мл
По уравнению Менделеева-Клапейрона
PV=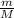 *RT
*RT
m=PVM/RT=(93*44):(8,314*(42+273))= 1,6 г
Объем переводим в литры (0,1л),
температуру в кельвинах (273+42),
R=31,5
Чтобы нигде не запутаться переводим все значения в систему СИ, поэтому: Дано: V = 750 мл = 0,75 л = 0,00075 м³
Т = 42°С = 315°К
Р = 93 кПа = 93000 Па
Найти: m - ?
1) Находим массу 1 моля углекислого газа:
М(СО₂) = 12 + 2*16 = 44 г/моль = 0,044 кг/моль
2) Уравнение Менделеева-Клапейрона
Р*V = (m/M)*RT
где: R - универсальная газовая постоянная, R = 8,314 Дж/(моль*К)
Отсюда находим массу газа
p * V * M 93000 * 0,00075 * 0,044
m = = = 0,00117 кг = 1,17 г
R * T 8,314 * 315
ответ: 1,17 г