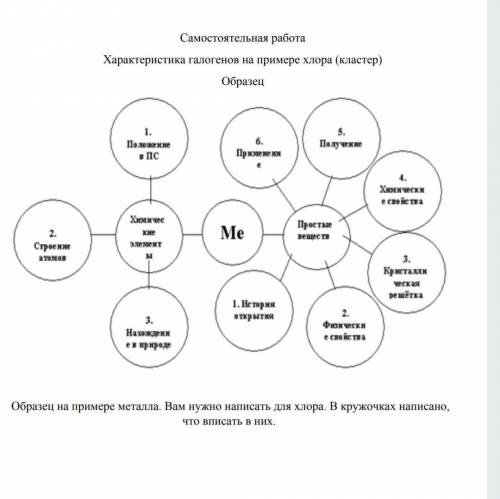
составить кластер на примере хлора
Другие вопросы по теме Химия
Популярные вопросы
- тест по истории/обществу, я хз...
1 - нужнаобчисліть кількость молекул і атомів що міститься в 28л сульфур...
3 - Тема: Свидетельства средневековых путешественников о Казахстане. Урок...
2 - ть хотяби з 3-4-ма задачами...
2 - The ratio of rock music to total CDs that Ella owns is 26. Paolo has...
2 - 2. Объём бассейна равен 100 м, стороны основания 10 ми5 м. Сколькоквадратных...
3 - найти. только дұрыс жауап...
2 - Решить первый вариант с дано и решение...
2 - Покупатель истратил в магазине половину всех наличных денег, после чего...
3 - Знайдіть довжину кола, радіус якого дорівнює 2π см. 4π2 см 4π см 2π см...
3
Хлор представляет собой элемент с атомным номером 17 и обозначением Cl в периодической таблице. Он находится в группе 17, известной как группа галогенов. Хлор является газообразным элементом при нормальных условиях, и у него есть зеленовато-желтый цвет.
Хлор имеет электронную конфигурацию [Ne] 3s2 3p5, что означает, что у него есть 17 электронов. Он имеет 7 электронов на внешнем энергетическом уровне, что делает его нестабильным и склонным к образованию связей с другими элементами.
Хлор образует кластеры с другими элементами путем обмена электронами, чтобы достичь стабильной электронной конфигурации. Он может образовывать кластеры с металлами, такими как натрий (Na), магний (Mg), алюминий (Al) и другими элементами группы 17, такими, как фтор (F), бром (Br) и йод (I).
Например, если рассмотреть кластер хлора с натрием (Na), хлоровый атом отдает один из своих электронов натрию, чтобы достичь стабильной электронной конфигурации. В результате образуется положительно заряженный ион натрия (Na+) и отрицательно заряженный ион хлора (Cl^-). Эти ионы притягиваются друг к другу на основе их противоположных зарядов и образуют кристаллическую структуру, которая называется хлорид натрия (NaCl).
То есть, кластер хлора в этом случае представляет собой ион хлора (Cl^-), объединенный с ионом натрия (Na+) в кристаллическую структуру хлорида натрия (NaCl).
В общем, кластер хлора может образовываться путем образования связей с другими элементами на основе их структуры и электронной конфигурации. Такие кластеры могут иметь различные формы и структуры в зависимости от свойств и химического поведения хлора и других элементов.