Сколько литров водорода выделится при взаимодействии 2,6г цинка с соляной кислоты
Другие вопросы по теме Химия
Популярные вопросы
- с английским, не понимаю, чень нужно ...
3 - На сторонах BC и CD ромба ABCD взяты точки M и N соответственно, отличные...
2 - ПротеОбъясПредметом изучения химии являются вещества.1.1. Внимательно...
2 - Назвать вещества по систематической номенклатуре...
3 - Напишите любые два эффективной организации производства...
1 - Повний фонетичний розбір слово дружньо...
1 - 1. Чи належить точка A(-3; 2) графіку рівняння:а) 5х + 12y = 9; б) 2x...
3 - Плотность географической оболчки/Щільність географічної оболонки а)...
3 - Тэтчеризм - написать несколько предложений, отражающие следующие четыре...
3 - Упражнение 3. ответьте на во используя придаточные цели, по образцу....
1
Zn+2HCl-->ZnCl₂+H₂ (это газ, поэтому нужно нарисовать стрелочку, направленную вверх)
Cначла нужно найти количество цинка по формуле n=m/M, где n-количество вещества, m-масса, M-молярная масса (она определяется по таблице Менделеева)
n(Zn)=2,6г:65г/моль=0,04моль
Теперь смотрим на коэффициенты перед цинком и водородом. Т. к. перед этими веществами нет никакой цифры, то их коэффициенты равны 1. Значит, их колличества равны.
n(H₂)=n(Zn)=0,04моль
Теперь можем найти объём водорода по формуле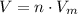 , где V-объём, n-количество вещества,
, где V-объём, n-количество вещества, 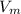 -молярный объём (у газов он всегда равен 22,4 л/моль)
-молярный объём (у газов он всегда равен 22,4 л/моль)
V(H₂)=0,04 моль·22,4л/моль=0,896л
ответ: 0,896л.
Zn+2HCl = H2+ZnCl2
n(Zn) = 2.6г:65г/моль = 0.04моль
n(Zn):1 = n(H2):1
n(H2) = 0.04 моль
V(H2) = Vm*n
V(H2)=22.4*0.04=0.896л