Сколько граммов средней соли получится при взаимодействии 10 г гидроксида натрия и 19,6 г серной кислоты
Другие вопросы по теме Химия
Популярные вопросы
- Назовите компоненты спинного мозга под цифрой 1 и 2на изображении:...
3 - ЗАДАНИЕ №2ВРЕМЯ НА ВЫПОЛНЕНИЕ:18:59ТЕКСТ ЗАДАНИЯЗАГРУЗКА ФАЙЛОВ...
1 - 1. Мәтінді мұқият оқып, төмендегі тест сұрақтарына жауап беріңіз. «Дәрумен»...
1 - Чому твір золотий жук мені сподобався більше ніж фільм(коротко)...
3 - Жадина которая лежит на высушенной траве отгадай слово из букв А О Б С...
1 - Task3. Find out the right voice(Past Simple / Past Continuous) in each...
1 - Внешний угол треугольника ABC при вершине А равен 130 градусов Найдите...
1 - Визначити роботу сили тертя, якщо маса автомобіля m = 900 кг і при гальмуванні...
2 - Із пункту А в напрямі пункту В виїхав перший велосипедист зі швидкістю...
2 - Решить неравенства (3x+5)²-(3x-6)(3x+6)...
2
17.75 г
Объяснение:
Уравнение реакции, соответствующий условию:
Вычислим количество вещества кислоты:
Посчитаем фактическое количество вещества щелочи:
Стало быть, щелочи взято в недостатке, поэтому считаем по гидроксиду.
По уравнению соли образуется в два раза меньше (по количеству вещества), поэтому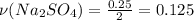
Теперь 0.125 умножаем на молярную массу соли (т.е. на 142)