Сколько амиачной селитры nh4 no3 должна получится при нейтрализации 15гр 20% раствори азотной кислоты раствором амиака?
Другие вопросы по теме Химия
Популярные вопросы
- Меньшевиктер эсерлермен бірлесіп «Біріккен социалистік одақты»...
2 - решите только на листке решение...
2 - Составь кластер на тему как взрослому...
3 - Вычислите растворимость Оксалата железа(II) и массу железа в 150...
3 - 5 предложений НЕ с глаголами...
1 - Как называют тюрскую письменность в науке? ппочему?...
3 - сделать русский язык Составьте план доклада о научной деятельности...
1 - 2. Bидстань между двумя городами мотоциклист проехал за 3:00. За...
1 - Я по матеш субн Субн ю ноууу...
1 - Назовити его морфологическии признаки...
3
Запишем уравнение реакции:
HNO₃ + NH₃ = NH₄NO₃
найдём молярные массы веществ:
Mr (HNO₃) = 1 + 14 + 16 * 3 = 63 г\моль
Mr (NH₄NO₃) = 14 + 1 * 4 + 14 + 16 * 3 = 80 г\моль
найдём массу HNO₃ в растворе:
m (HNO₃) = 15 * 0,2 = 3 г
теперь составим пропорцию:
из 1 моль HNO₃ получается 1 моль NH₄NO₃, тогда
из 63 г HNO₃ получается 80 г NH₄NO₃
из 3 г NHO₃ получается x NH₄NO₃
x = 80 * 3 / 63 = 3,81 г
ответ: 3,81 г
Дано:
m р-р(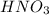 ) = 15 г
) = 15 г
ω(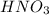 ) = 20%
) = 20%
m(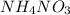 ) — ?
) — ?
Реакция нейтрализации азотной кислоты раствором аммиака —
Найдём массу азотной кислоты в растворе:
m(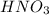 ) = m р-р(
) = m р-р(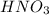 ) * ω(
) * ω(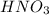 ) = 15 г * 0,2 = 3 г.
) = 15 г * 0,2 = 3 г.
Исходя из полученного результата, выйдем на количество азотной кислоты:
n(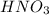 ) = m(
) = m(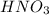 ) / M(
) / M(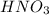 ) = 3 г / 63 г/моль ≈ 0,0476 моль
) = 3 г / 63 г/моль ≈ 0,0476 моль
Так как по уравнению индексы при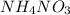 и
и 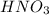 совпадают, то их количество равно:
совпадают, то их количество равно:
n(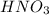 ) = n(
) = n(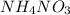 ), следовательно
), следовательно
n(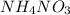 ) = 0,0476 моль.
) = 0,0476 моль.
Тогда масса нитрата аммония равна
m(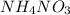 ) = n(
) = n(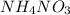 ) * M(
) * M(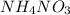 ) = 0,0476 моль * 80 г/моль ≈ 3,8 г
) = 0,0476 моль * 80 г/моль ≈ 3,8 г
ответ: m(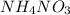 ) = 3,8 г.
) = 3,8 г.