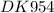Расставьте коэффициенты в уравнении окислительно-восстановительной реакции методом электронно-ионного баланса. Запишите уравнение Нернста для полуреакции восстановления.
Рассчитайте для этой реакции ΔЕо , К равновесия и ΔGо
K2Cr2O7 + KNO2 + H2SO4 → Cr2(SO4)3 + KNO3 + K2SO4 + H2O
Другие вопросы по теме Химия
Популярные вопросы
- Предмет был на расстоянии 50 см от плоского зеркала, затем его...
2 - :с в конституции германии есть разделы прав человека и прав гражданина...
1 - Работа по обществознанию почему воспитание самая трудная работа...
1 - Цитатна характеристика образiв, мати i дiда, з твору гуси-лебедi...
1 - Придумай басню о том, что у страха глаза велики....
2 - нужно разводить животных,которые находятся в термодинамическом...
2 - Чего моряк боится в море, чем девушка гордится, и что мужик прячет...
2 - Надо выделить орфограммы в предложении: поезд тронулся,и за окном...
1 - Поставить знаки и скобки между 1 2 3 4 5 6 7 8 что равно было 2?...
1 - Решите систему уравнений и уравнение! . 2^x+2^y=10 x+y=4 7^x+1...
2
K₂Cr₂O₇ + KNO₂ + H₂SO₄ → Cr₂(SO₄)₃ + KNO₃ + K₂SO₄ + H₂O
2K⁺ + Cr₂O₇²⁻ + K⁺ + NO₂⁻ + 2H⁺ + SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + K⁺ + NO₃⁻ + 2K⁺ + SO₄²⁻ + H₂O
Cr₂O₇²⁻ + NO₂⁻ + 2H⁺ → 2Cr³⁺ + NO₃⁻ + H₂O
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ → 2Cr³⁺ + 7H₂O | 6 | | 1 | - окислитель
| | 6 | |
NO₂⁻ + H₂O - 2е⁻ → NO₃⁻ + 2H⁺ | 2 | | 3 | - восстановитель
---------------------------------------------------------------------------------------------------------
Cr₂O₇²⁻ + 14H⁺ + 6e⁻ + 3NO₂⁻ + 3H₂O - 6е⁻ → 2Cr³⁺ + 7H₂O + 3NO₃⁻ + 6H⁺
Cr₂O₇²⁻ + 3NO₂⁻ + 8H⁺ → 2Cr³⁺ + 4H₂O + 3NO₃⁻
2K⁺ + Cr₂O₇²⁻ + 3K⁺ + 3NO₂⁻ + 8H⁺ + 4SO₄²⁻ → 2Cr³⁺ + 3SO₄²⁻ + 3K⁺ + 3NO₃⁻ + 2K⁺ + SO₄²⁻ + 4H₂O
В итоге получаем:
K₂Cr₂O₇ + 3KNO₂ + 4H₂SO₄ → Cr₂(SO₄)₃ + 3KNO₃ + K₂SO₄ + 4H₂O
Далее мы где решали уравнение полуреакций мы их находим в табличном значений, потом находим ЭДС и в итоге определим самопроизвольного протекания реакции между ними:
E(окислителя) = 1,33 В E(восстановителя) = 0,84 В
ε = E(окислителя) - E(восстановителя) = 1,33 В - 0,84 В = 0,49 В
ΔG = -ε = -(+0,49 В) = -0,49 В - протекает самопроизвольно
Теперь находим констант равновесия из полуреакций по уравнению Нернста:
lg K = ( n×(E(окислителя) - E(восстановителя) ) / 0,059 , где
n - общее число электронов
lg K = ( 6×(1,33 - 0,84) ) / 0,059
lg K = ( 6×0,49 ) / 0,059
lg K = 2,94 / 0,059
lg K ≈ 49,83 ⇒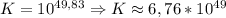
ответ: ε = 0,49 В, ΔG = -0,49 В ,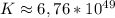
Решено от :