Рассчитать, какая масса кислорода потребуется для реакции с 44,8 г железа Схема реакции: Fe + O2 → Fe2O3 m(Fe) = 44,8 г m(O2) - ? можно с объяснением !
Другие вопросы по теме Химия
Популярные вопросы
- Сделать нужно! протаптываем буквы! представьте что во дворе лежит...
1 - Окружность задана уравнением х^2+(у-1)^2=4 какая из данных точек принадлежит...
2 - Впрямоугольном треугольнике угол с равен 90°, cd перпендикулярно ab....
1 - Можете записать и решить её к этому примеру 40: 6+4...
1 - Обчисліть об єм вугликислого газу, який утворюється при згоранні пентану...
2 - Яка проблема не порушена у творі тигролови ? а)патріотизму б)бородьба...
3 - Укажите какая пара веществ из указанных ниже может реагировать с друг...
3 - Взаписи 88888888 расставьте между некоторыми цифрами знаки сложения...
1 - Наиболее простым найдите значение выражения : а) 3,05 * 32 + 3, 05...
3 - Гриб из 10 букв (только не подберёзовик)...
1
Дано :
m(Fe) = 44,8 г.
Найти :
m(O₂) = ?
Уравнение химической реакции —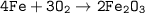 .
.
По уравнению реакции — n(Fe) : n(O₂) = 4 : 3, отсюда следует, что 3n(Fe) = 4n(O₂) ⇒ n(O₂) =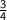 *n(Fe).
*n(Fe).
Найдём количество вещества железа —
n(Fe) = m(Fe) : M(Fe) = 44,8 г : 56 г/моль = 0,8 моль.
Тогда по выше сказанному — n(O₂) =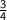 *n(Fe) =
*n(Fe) = 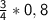 моль = 0,6 моль.
моль = 0,6 моль.
Найдём массу кислорода —
m(O₂) = n(O₂)*M(O₂) = 0,6 моль*32 г/моль = 19,2 г.
19,2 г.