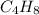При сжигании углеводорода массой 5,6 г образовалось 8,96 л углекислого газа и 7,2 г воды. определите молекулярную формулу вещества, если относительная плотность по водороду равна 28
Другие вопросы по теме Химия
Популярные вопросы
- Вдвух кусках поровну ткани.после того как от первого куска продали 14м,а...
2 - Внаписании сочинения на тему волшебная сказка .ребенок учится в 3 классе...
1 - Воду какой массы можно нагреть от 20 до 100 *с ,затратив 1 квт *ч энергии...
2 - Когда был создан международный олимпийский комитет (мок), и кто в нём представлял...
2 - Для оплавления гололеда на проводе электрической железной дороги по проводу...
2 - Точка а лежит в плоскости ,точка в на расстоянии 12,5м от плоскости.найдите...
3 - Заменить словосочетания одним словом. принять сделать белым...
3 - Уменьшите число: а)60 на 10%; б)500 на 28%: в)90 на 50%: г)125 на 40%...
1 - Вромбе abcd из вершины тупого угла в к стороне ad проведена высота вк и к...
3 - Во сколько раз надо уменьшить длину маятника чтобы переод его колебаний уменьшился...
2
Объяснение:
Определим массу углерода и водорода, который входил в состав углеводорода
Соотношение атомов между углеродом и кислородом равно:
То есть простейшая формула выражается как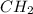
Если плотность по водороду составляет 28, то молярная масса углеводорода равна 28 * 2 = 56 г/моль.
Теперь, зная соотношения атомов углерода и кислорода, и соответствующую молярную массу углеводорода, можно составить уравнение:
Истинная формула углеводорода - это