При сгорании 1 л с2н4 при нормальных условиях выделяется 59,06 кдж теплоты. определить стандартную энтальпию образования этилена.
Другие вопросы по теме Химия
Популярные вопросы
- По материалам параграфа заполните таблицу кочевые народы на...
2 - Horses / lay/eggs? как расшифровать?...
3 - Два человека вышли навстречу друг другу в 9 часов утра и встретились...
1 - Спишите текст , подбирая нужное слово . любил фиалки поэт гёте...
1 - Всем ! подскажите условие и решение к в школе № 1 учится 30...
3 - Укажите вариант. в котором дано верное толкование фразеологизма...
2 - Раскрыть квадрат суммы (6x+3)и все в квадрате...
2 - :oa=15cм od=5см co/ob=1/3 ab+cd=24 найти ab и cd...
1 - Написать тест из 5 вопросов в рамках темы древняя греция...
2 - 6(x-y)-12(x-y)^2 (a^2-b^3)-5(b^3-a^2)-3k(a^2-b^3)...
2
Реакция горения этилена:
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(г)
n =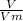 =
= 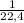 ≈ 0,045 моль
≈ 0,045 моль
ΔH = -59,06 кДж : 0,045 моль ≈ -1312,4 кДж/моль
ΔH = 2*ΔH°обр. (CO2) + 2*ΔH°обр. (H2O) - 1*ΔH°обр. (C2H4) - 3*0 - 1312,4 кДж/моль
примем ΔH°обр. (C2H4) за Х, тогда:
2*(-395,5) + 2*(-241,8) - Х
Х = -781 + (-483,5) + 1312,4
Х = 41,5 кДж/моль
ответ: 41,5 кДж/моль