При окислении фосфина перманганатом калия в присутствии серной кислоты образуется 24,5 г фосфорной кислоты. определите массы (г) окислителя, учавствовавшего в данной реакции.
Другие вопросы по теме Химия
Популярные вопросы
- Заморозьте в холодильнике воду. Получившийся кусок льда раздробите,...
1 - Стальное сверло массой 100 г нагрелось при работе от 15 до 115℃....
3 - Какое количество теплоты необходимо передать газу, чтобы его внутренняя...
3 - Определите массу сухих дров, которые нужно сжечь для того, чтобы...
1 - Чему равна удельная теплота сгорания топлива, если при полном сгорании...
2 - Чему равно изменение внутренней энергии газа, если ему было передано...
3 - Стальной ударник пневматического молотка массой 1,2 кг нагрелся во...
2 - При сжигании дров массой 0,42 кг воду в самоваре нагрели от 20 до...
3 - Определите коэффициент полезного действия самовара, если для нагревания...
3 - Чему равна масса дров, которые нужно сжечь, чтобы нагреть до кипения...
3
Сложность в этой задаче, заключается лишь в уравнении. Главное его уравнять:D
Поехали, пишем уравнение:
Окислиетль здесь всегда был, есть и видимо будет - марганцовка -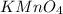
Теперь решаем. Тут все очень просто:
Рассчитаем количество вещсвта фосфорной кислоты:
По уарвнению реакции видим:
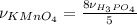 = 0,4 моль
= 0,4 моль
Рассчитаем массу:
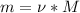 = 0.4моль*158г/моль = 63.2 грамма
= 0.4моль*158г/моль = 63.2 грамма