Почему у cr электронная кофигурацияя 4s1 ? а у других 4s2
Другие вопросы по теме Химия
Популярные вопросы
- 3. Запишите словесные уравнения реакций горения между углеродом и кислородом,...
1 - Радиус круга 3,75см. Найди длину окружности, которая его ограничивает. ответ...
3 - Вынеси множитель из-под знака корня: √8. ответ: √2....
1 - Значение квадратного корня √121⋅16 равно:...
1 - По словам Ясауи его учитель Арыстан Баба осуждает эти качества в человеке...
3 - Определите продукт коррозии и тип деполяризации кобальтового изделия, покрытого...
3 - Решите буду очень благодарен!...
3 - Знайдіть значення функції при заданих значеннях аргумента: y=18:x-3; x=0; x=-6...
1 - Преобразуйте в многочлен (a-b)(a+b)...
1 - как будет на казахском словами 1320км и 100млн...
3
Порядок заполнения электронами атомных орбиталей определяется:1.Принципом наименьшей энергии(картинка 1).
2. Состояние атома с полностью или наполовину заполненным подуровнем (т. е. когда на каждой орбитали имеется по одному неспаренному электрону) является более устойчивым.Этим объясняется «провал электрона. (картинка 2)
Атом хрома имеет электронную конфигурацию не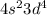 , a
, a 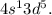 Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней
Это является примером того, как стабилизация состояний с параллельными спинами электронов преобладает над незначительной разницей энергетических состояний подуровней 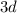 и
и 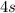 (правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются
(правила Гунда), то есть энергетически выгодными состояниями для d-подуровня являются 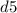 и
и 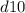 .
.
Подобный переход одного электрона с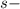 подуровня на
подуровня на 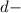 подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd происходит переход двух
подуровень происходит еще у 8 элементов: Cu, Nb, Mo, Ru, Ag, Pt, Au. У атома Pd происходит переход двух 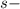 электронов на
электронов на 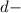 подуровень: Pd:
подуровень: Pd: 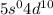 .
.