Определить молярность и рН раствора HCN, если концентрация гидроксид-ионов в нем состовляет 10моль/л. 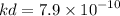
Другие вопросы по теме Химия
Популярные вопросы
- Click the correct option to answer the question...
2 - Опиши озеро на первой фотографии. На что похожа его поверхность -...
2 - пример решить по действиям, ...
3 - приведите пример смекалки из жизнине из интернета...
1 - Является ли сложным предложением В лесу живут звери и птицы: зайчата,волчата...
3 - Имеют ли уравнения корни? Если имеют, то сколько, рациональными или...
3 - Автівка, рухаючись зі швидкістю 72 км/год, за t годин долає відстань...
3 - Математика по 5клас каз номер647...
1 - Известно частное 6 и делитель 30 чему равно делимое?...
3 - Зат есімнің жекеше жəне көпше түрі помагит...
3
Шаг 1: Запишем уравнение реакции, чтобы определить концентрацию ионов HCN и КНО на основе константы диссоциации (Kd):
HCN ⇌ H+ + CN-
Kd = [H+][CN-]/[HCN]
Шаг 2: Определим концентрацию ионов H+ в растворе. Поскольку раствор является кислотным, концентрация ионов H+ будет равна концентрации гидроксид-ионов:
[H+] = 10 моль/л
Шаг 3: Определим концентрацию ионов CN-. Поскольку HCN диссоциирует полностью, концентрация ионов CN- будет также равна концентрации ионов HCN:
[CN-] = 10 моль/л
Шаг 4: Подставим значения концентраций ионов H+ и CN- в уравнение диссоциации:
Kd = (10 моль/л)(10 моль/л)/[HCN]
Шаг 5: Решим уравнение для определения концентрации HCN:
Кd = 7.9 × 10^-10 (это дано в условии)
(10 моль/л)(10 моль/л)/[HCN] = 7.9 × 10^-10
[HCN] = (10 моль/л)(10 моль/л)/(7.9 × 10^-10)
[HCN] ≈ 1.27 × 10^10 моль/л
Итак, молярность раствора HCN составляет примерно 1.27 × 10^10 моль/л.
Шаг 6: Определение рН раствора с использованием скинутых данных:
pH = -log[H+]
pH = -log(10 моль/л)
pH ≈ -log(1) (поскольку концентрация ионов H+ равна 10 моль/л)
pH ≈ 0
Итак, рН раствора HCN равно примерно 0.
Я надеюсь, что это решение было понятным и подробным. Если у вас есть еще вопросы, пожалуйста, не стесняйтесь задавать их!