Написать уравнения реакций обмена в молекулярном и ионном виде, для окислительно-восстановительных реакций составить электронный баланс ЗА ВЫПОЛНЕНИЕ ВСЕГО
Другие вопросы по теме Химия
Популярные вопросы
- При каких условиях выражения будут равны: 7,6-2х и 3,6-х...
3 - За круглым столом сидят 60 человек, каждый из них — рыцарь или лжец. каждый...
2 - Решить коши. 1. y =3e^x+1 y(0)=1 2.y =(x/6)+sin(x) y(0)=3 y (0)=1...
1 - Решение и проверка уравнения х-568=583-351...
1 - Мальчик поднимает тело массой 0,5 кг с пружины жёсткостью 200 н/м. в этом движении...
1 - Вравнобедренном треугольнике abc точка k и m являются серединками боковых сторон...
3 - Мастер отремонтировал 35 приборов, что составило 5/12 от общего количества приборов....
2 - Найдите предложение с ошибкой в постановке дефиса. a) река-ишим протекает через...
3 - Сколькими можно разделить 14 спортсменов на две команды по 7 человек?...
1 - 34 .составьте 10 вопросов к тексту: the tsiolkovsky museum of the history of...
2
Объяснение:
Написать уравнения реакций обмена в молекулярном и ионном виде, для окислительно-восстановительных реакций составить электронный баланс.
ЗА ВЫПОЛНЕНИЕ ВСЕГО
1 2 3 4
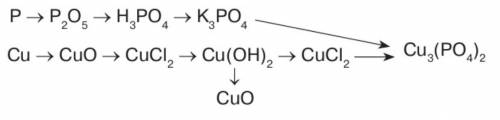
P ---> P2O5 --> H3PO4 > K3PO4 ---> Cu3(PO4)2
0 0 +5 -2
4P + 5O2 = 2P2O5
2P(0) - 10e = P2(+5) окисление, Р - восстановитель ║ 2
O2(0) + 4e = 2O(-2) восстановление, О2 - окислитель ║ 5
Р205 + 3Н2О = 2Н3РО4
Н3РО4 + 3KOH = K3PO4 + 3H2O
3Н+ + PO4(3-) + 3K+ + 3OH - = 3K+ + PO4(3-) + 3 H2O
3Н+ + 3OH - = 3 H2O
2К3PO4 + 3CuSO4 = Cu3(PO4)2↓ + 3K2SO4
6K+ + 2PO4(3-) + 3Cu2+ + 3SO4(2-) = Cu3(PO4)2↓ + 6K+ + 3SO4(2-)
2PO4(3-) + 3Cu2+ = Cu3(PO4)2↓
1 2 3 4 5
Cu ---> CuO > CuCl2 > Cu(OH)2 > CuCl2 ---> Cu3(PO4)2
I 6
CuO
0 0 +2 -2
2Cu + O2 = 2CuO
Cu(0) - 2e = Cu+2 окисление, Cu - восстановитель
O2(0) + 4e = 2O(-2) восстановление, О2 - окислитель
CuO(тв) + 2HCl = CuCl2 + H2O
CuO(тв) + 2H+ + 2Cl(-) = Cu2+ + 2Cl(-) + H2O
CuO(тв) + 2H+ = Cu2+ + H2O
СuCl2 + 2 NaOH = Cu(OH)2↓ + 2NaCl
Cu2+ + 2Cl(-) + 2Na+ + 2OH - = Cu(OH)2↓ + 2Na+ + 2Cl(-)
Cu2+ + 2OH - = Cu(OH)2↓
Cu(OH)2(тв) + 2НСl = CuCl2 + 2H2O
Cu(OH)2(тв) + + 2H+ + 2Cl(-) = Cu2+ + 2Cl(-) + 2H2O
Cu(OH)2(тв) + + 2H+ = Cu2+ + 2H2O
t
Cu(OH)2 > CuO + H2O↑
3CuCl2 + 2 Na3PO4 = Cu3(PO4)2↓ + 6NaCl
3Cu2+ + 6Cl - + 6Na+ + 2PO4(3-) = Cu3(PO4)2↓ + 6Na+ 6Cl -
3Cu2+ + 2PO4(3-) = Cu3(PO4)2↓