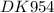Написать катодный и анодный процессы, уравнение токообразующей реакции и вычислить ЭДС гальванического элемента. Указать полярность электродов.
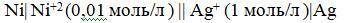
Другие вопросы по теме Химия
Популярные вопросы
- Написати твір-роздум «Мій шлях до Кобзаря»...
1 - жауабын айтыныздарш берем керек!...
1 - Составьте синквейн «Дочь» по произведению А. С. Пушкина «Станционный смотритель»....
3 - сделать (прикрепленный файл)...
3 - Дмитрий купил 112 баранов- молодых и старых, заплатив 49 рублей и 20 алтын. За...
1 - 1) Распределите кости по типам : лопатка, ребра, теменные кости, бедренная кость,...
2 - Изобразите на плоскости ХОY множество точек z = x + yi удовлетворяющих условию...
2 - Прочитайте стихотворение Б. Слуцкий. 2. Сделайте произведения по плану.План анализа...
1 - ПРАКТИЧНА РОБОТА No 1 Визначення напрямків, відстаней, площ, географічних, пря-мокутних...
3 - 303. Знайдіть, користуючись транспортиром, градусну міру кутів, зображених на...
3
1) Для начала мы запишем схему гальванического элемента:
Ni | Ni⁺² (0,01 моль/л) || Ag⁺ (1 моль/л) | Ag
2) Далее мы определяем какой из них катод и анод, значит из этого гальванического элемента:
Ni - Анод Ag - Катод
A⁻ : Ni | Ni⁺² (0,01 моль/л) || Ag⁺ (1 моль/л) | Ag : K⁺
3) Теперь записываем гальванические процессы у катода и анода и потом получим уравнение токообразующей реакции :
K⁺ : Ag⁺ + 1e⁻ → Ag⁰ | 1 | | 2 | - окислитель E₁⁰ = +0,80 В
| | 2 | |
A⁻ : Ni⁰ - 2e⁻ → Ni⁺² | 2 | | 1 | - восстановитель E₂⁰ = -0,25 В
2Ag⁺ + 2e⁻ + Ni⁰ - 2e⁻ → 2Ag⁰ + Ni⁺²
2Ag⁺ + Ni⁰ → 2Ag⁰ + Ni⁺² - токообразующая реакция
4) Теперь находим ЭДС у катода и анода по такой формуле:
E(Ni⁺²/Ni) = -0,25 В + 0,059/2 × lg(0,01) = -0,25 В + 0,0295 × lg(10⁻²) = -0,25 В + 0,0295 × (-2) = -0,25 В - 0,059 = -0,309 В
E(Ag⁺/Ag) = 0,80 В + 0,059/1 × lg(1) = 0,80 В + 0,059 × 0 = 0,80 В + 0 = 0,80 В
5) Теперь находим ЭДС по полученным значениях :
ε = E(катод) - E(анод) = E(Ag⁺/Ag) - E(Ni⁺²/Ni) = 0,80 В - (-0,309 В) = 0,80 В + 0,309 В = 1,109 В
ответ: ε = 1,109 В
Решено от :