На состояние химического равновесия в системе Н2 (г.) + I2(г.) ↔ 2HI (г.) – Q не оказывает влияния:
увеличение температуры
увеличение концентрации I2(г.)
увеличение давления
уменьшение температуры
Другие вопросы по теме Химия
Популярные вопросы
- Образуйте сравнительную и превосходную степени прилагательных ( big - bigger...
2 - Lim (sim2x/sin3x)=... x→0*...
1 - В ГОСТе на дизельное топливо в показателе «температура вспышки в закрытом...
3 - Базальт является... а) магматической горной породой б) осадочной горной породой...
1 - В настоящее время там находится полночь и она расположена в 120 градусов к...
2 - Решить задание, которое показано на фото....
2 - Решите уравнение! Решите уравнение Решите уравнение...
2 - Происхождение большого соленого озера...
2 - ХЕЛП прийшле населення (переселенці) Північної Амереки...
3 - чому мешканці водойм значно поступаються гостротою зору більшостіназемних...
2
увеличение давления
Объяснение:
Изменение температуры влияет на равновесие, поскольку ΔG=ΔH-TΔS, а K - константа равновесия = exp(-ΔG/R/T)=exp((TΔS-ΔH)/R/T)=exp(ΔS/R-ΔH/R/T) также K равна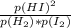 так как сверху и снизу давление во второй степени суммарно, то K=
так как сверху и снизу давление во второй степени суммарно, то K= 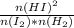 то есть при изменении концентрации иода равновесие сместится, а при изменении давления - нет, таким образом, ответ 3 - увеличение давления
то есть при изменении концентрации иода равновесие сместится, а при изменении давления - нет, таким образом, ответ 3 - увеличение давления