Масса гидроксида бария, который потребуется для полной нейтрализации 98г раствора серной кислоты с массовой долей раствореного вещества 38,3%, составляет xг. найти чему равно это x грамм.
Другие вопросы по теме Химия
Популярные вопросы
- Пример 8·2+23-24разделить 8·3+17 действяями...
3 - Как описать свою характер? какой нужен план?...
2 - Расказ по кто напишет? ? про супер зарание ))...
1 - Сочинение на тему: если бы мне предстояло охарактеризовать человека, то я рассказала...
1 - :прочитайте предложения.измените их так,чтобы получились простые предложения...
3 - Начерти ломанную из трех звеньев длинна которой 9 см...
2 - Мой брат отличный спортсмен, найти подлежащие и сказуемое в этом предложении...
2 - 150 ! какие изобразительно-выразительные средства используются в стихотворении...
3 - Словосочетания с фразеологизами и со словами рука нога и голова...
1 - Запишите десятичные дроби в виде обыкновенных и сократите их 0,4 0,2 0,8 0,75...
1
Дано
ω (Н2SO4) = 38,3%
m(р-ра Н2SO4) = 98гр
Найти:
m(Ва(ОН)2) - ?
m = 38 гр Хгр
Н2SO4 + Ва(OH)2 = ВaSO4 + 2H2O
m=98гр m=171гр
ω = m(в-ва) х 100% / m( р-ра)
m(в-ва) = ω х m( р-ра) / 100%
m(H2SO4) = 38,3% x 98гр /100% = 38гр
Находим массу гидроксида бария, составляем пропорцию
38гр / 98гр = Хгр / 171гр
m(Ва(ОН)2) = 38гр х 171гр / 98гр = 66,3 гр
Уравнение реакции:
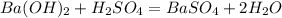
 98*0,383 = 37,534 г.
98*0,383 = 37,534 г.
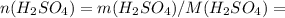 37,534 / 98 = 0,383 моль
37,534 / 98 = 0,383 моль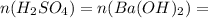 0,383 моль
0,383 моль
 = 0,383 * 171 = 65,493 г.
= 0,383 * 171 = 65,493 г.
Необходимо найти количество вещества серной кислоты и сравнить его с количеством вещества гидроксида бария:
Масса серной кислоты :
По уравнению реакции,
Теперь можно найти массу гидроксида бария:
ответ: 65,494 г.