Кто чем может)) 20 пунктов)) №1 расчитайте массу (г) продукта, который получится при взаимодействии 48 г магния с водой. при каком условии протекает эта реакция. p.s. знаю что получиться должно 160 г, и формула mgo + h2o --> mg(oh)2 №2 определите является ли щелочью: а) гидроксид рубидия; б) гидроксид меди(ii); в) гидроксид лития; г) гидроксид натрия; д) гидроксид железа(ii); е) гидроксид цинка; ж) гидроксид калия; з) гидроксид бария. составьте уравнение реакции основания с хлороводородной кислотой и рассчитайте массу (г) образовавшейся соли, если в реакцию вступило 73 г раствора кислоты с массовой долей хлороводорода 4,5 %. p.s. ответы: а) 108,9 б) 60,75 в) 38,25 г) 52,65 д) 57,15 е) 61,20 ж) 67,05 з) 93,60
Другие вопросы по теме Химия
Популярные вопросы
- Нужен ответ на вопрос: почему человеческому обществу нужен порядок? как его установить?...
1 - На трех пальмах сидят попугаи.если с первой пальмы на вторую перелетят два попугая...
3 - На стронах ab,bc,ac равностороннего треугольника abc соответственно отмечены точки...
1 - За какое время улитка имеющая скорость 1,5см преодолеют расстояние 30 сантиметров...
2 - Чим омоніми відрізняються від багатозначних слів? навести приклади....
1 - Допишите словосочетания а за ними виднелись черепичные крыши. где? за ними, какие?...
1 - Какие бывают на деление с остатком?...
3 - Подскажите проверочное слово к слову разговаривают . д/з с этим на завтра !...
2 - Перевести текст с языка на украинский about americans food...
1 - Путешественник идет из одного города в другой за 10 дней. а другой путешественник...
2
№1. Дано:
m(Mg)=48 г
______________________
m(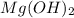 )=?
)=?
2 моль x
1 моль 1 моль
n(Mg)=m/M=48г/24г/моль=2 моль
m(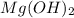 )=n*M=2 моль* 42г/моль=84 г
)=n*M=2 моль* 42г/моль=84 г
ответ: 84 г
С твоим ответом не сошлось, т.к. у тебя реакция неправильная.
№2. а, в, г, ж
№3. Дано:
m(HCl)=73 г
__________________________
m(NaCl)=?
0,09 моль х
2 моль 1 моль
m(HCl)=73г*4,5%/100%=3,285 г
n(HCl)=3,285г/36,5г/моль=0,09 моль
x=n(NaCl)=0,045 моль
m(NaCl)=0.045 моль*58,5г/моль=2,6325 г
ответ: 2,6325 г