Какой обьем углекислого газа выделится при взаимодействии 500 г 30%-ной соляной кислоты с карбонатом кальция?
Другие вопросы по теме Химия
Популярные вопросы
- Нужно написать письмо персонажу (из книги, фильма) или предмету (например: игрушке),...
2 - и сделаю ответ лучшим. Разложите на множители группировки...
3 - из одного города одновременно в одном направлении выехали два автобуса. первый...
1 - Написати скаргу про порушення прав споживача. 80 б. (9 класс)...
3 - Як ви розумієте вислів: «Конституція визначає форму держави. Україна – унітарні...
3 - Снежная королева 1. Почему оказалось возможным похищение Кая? 2. Опиши владения...
3 - 1) Найти тангенс угла наклона касательной к графику у= sinх в точке х0=0. 2)...
1 - Найдите числовое значение выражения: 5а+47в-37:с при а=14,в=6...
2 - Контрольная робота Геометрія( )...
1 - ОТВЕТИТЬ, ОТВЕТ НЕ ПО ТЕМЕ ЖАЛОБА И 1 ЗВЕЗДА....
2
Дано:
mр-ра(HCl) = 500г.
Wр.в(HCl) = 30%
Найти:
V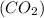 - ?
- ?
1) Рассчитаем массу чистого вещества соляной кислоты: mчист.в-ва(HCl)= mр-ра(HCl) * Wр.в(HCl) / 100%= 500г. * 0,3=150г.;
2) Рассчитаем количество в-ва соляной кислоты, выделевшегося в ходе реакции: n(HCl)= mчист.в-ва(HCl) / M(HCl)= 150г. / 36,5 г/моль= 4,1 моль;
3) Рассчитаем количество в-ва углекислого газа по уравнению реакции: n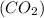 = n(HCl) / 2= 4,1 моль / 2=2,05 моль;
= n(HCl) / 2= 4,1 моль / 2=2,05 моль;
4) Зная кол-во в-ва, можно определить объём углекислого газа: V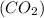 = n
= n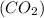 * Vm= 2,05 моль * 22,4 л/моль= 46 л.
* Vm= 2,05 моль * 22,4 л/моль= 46 л.
ответ: V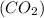 = 46л. Всё!
= 46л. Всё!
-------------------------------------------------------------------------------------------------
Есть вопросы? Задавай Тык