Какой объем углекислого газа необходимо пропустить через раствор гидроксида кальция, чтобы получилось 50 г карбоната кальция ?
Другие вопросы по теме Химия
Популярные вопросы
- Что получится если к вычитаемому прибавить разность?...
2 - Линию, которую описывает тело при своем движении называется А) Пройденный...
1 - Как называется молоко у лошади...
3 - Определите коэффициент и степень:...
2 - Выполните действия и найдите значение полученного выражения НУЖНО ...
1 - НАДО СОЧЧ Задания суммативного оценивания за 1 четверть по предмету «Русская...
2 - Yupiter sayyorasi haqida maʼlumot...
2 - Приведите по два примера иллюстрирующих моделей корень,суффикс еньк и...
1 - Без обмана или забакирую и в спам ...
3 - Складіть невелику розповідь про дружбу. Використайте фразеологізми: водою...
3
1. Вычисляем количество моль карбоната кальция через его массу:
2. Зная коэффициенты уравнения, можем составить отношение моль карбида кальция к углекислому газу:
3. Зная количество моль углекислого газа, можно вычислить его объём:
ответ: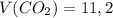 л
л