Какая масса и объем водорода выделится при взаимодействии 500 г 20% раствора соляной кислоты с цинком
Другие вопросы по теме Химия
Популярные вопросы
- У выражение - 12а-25b+18а+14b...
3 - 6сынып тжб қазақстан тарихы 4тапсырманын жауабы...
1 - Назвіть основні творчі професії задіяні в кіноіндустрії...
1 - Гитлердің КСРО-ға әскери шабуыл жасау туралы жоспарының аталуы ...
3 - нужно б Итоговая контрольная работа по английскому языку 7 класс I. READING. Read...
2 - Як називається переміщення вугра європейського з прісних водойм до Саргасового...
1 - Змінення пір року а)12 годин б)1 грудня-30 листопада в)приблизно 29,5 діб...
3 - Разложите на множители: 1) 5x^2y^2 − 45y^2c^2 2) 2x^2 + 24xy + 72y^2...
3 - В каком словосочетании использовано разносклоняемое существительное среднего рода,в...
2 - Будь-ласка будь-ласка будь-ласка до ть...
3
Zn + 2HCl = ZnCl₂ + H₂
mр-ра(HCl) = 500г
ω(HCl) = 20% = 0.2
mв-ва(HCl) = mр-ра × ω = 500г × 0.2 = 100г
n(HCl) =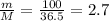 моль
моль
n(HCl) = n(H₂) = 2.7 моль ÷ 2 = 1.35 моль
m(H₂) = n × M = 1.35 моль × 2г\моль = 2.7г
V(H₂) = n × Vm = 1.35 моль × 22.4 л\моль = 30.24 л