H₂S+SO₂ →S + H₂O
восстановление и окисления
Другие вопросы по теме Химия
Популярные вопросы
- Знайдіть довжину кола якщо радиус 4,5 смУмоляю очень кр. ...
1 - подставить нужную ФОРМУЛУ из финансового менеджмента, расчёт не нужен. Клиент...
2 - Нужно сделать с остатком 6372:12 10914:34 3912:12 6405:15 10104:12 3945:15...
2 - При каком значении m векторы a (2; -1; 3) и b (1; 3; m) перпендикулярны?...
3 - Яка вкладка у вікні Інспектор об’єктів відображає видиму сторону компонента...
3 - Как выглядела земская больница? Каковы были пациенты? Какие чувства вызывает...
3 - Тебе мой маленький дружок не нужно ничего бояться сказал дядя Саша.Где нужны...
2 - Диалог с обязательными словами: ожидать или ждать/переждать...
3 - Вкажіть особливості та головні риси національної політики Польщі, Румунії,...
3 - Текст Генрых Далидович Губаты .Белорусская Литература.Нужен ответ на 3-е....
2
Запишем уравнение:
Расставим степени окисления:
Запишем редокс:
Сера и восстановитель и окислитель, то есть это реакция диспропорционирования
Расставим коэффициенты, чтобы уравнять реакцию:
Следовательно перед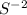 ставим двойку, а перед
ставим двойку, а перед 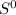 тройку, перед водой двойку чтобы уравнять водород:
тройку, перед водой двойку чтобы уравнять водород:
В данной реакции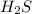 - восстановитель,
- восстановитель, 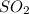 - окислитель
- окислитель