ГИДРОЛИЗ СОЛЕЙ При растворении солей в воде, наряду с процессами электролити-ческой диссоциации с образованием гидратированных ионов, протекают реакции взаимодействия ионов соли с водой их гидратных оболочек. Этот процесс называется гидролизом солей. В результате гидролиза смещается равновесие электролитической диссоциации воды, приводя-щее к изменению рH среды, которое можно определить с ин-дикаторов.
Например, при растворении ацетата натрия среда становится ще-лочной в результате протекания следующих процессов:
NaCH3COO Na+ + CH3COO-
CH3COO- + HOH CH3COOH + OH-
Изменение водородного показателя рH при растворении соли явля-ется основным признаком, указывающим на протекание гидролиза.
Гидролиз является результатом поляризационного взаимодействия ионов с их гидратной оболочкой. Чем сильнее поляризующее действие ионов и больше их поляризуемость, тем в большей степени протекает гидролиз. Сильное поляризующее действие оказывают небольшие по размеру многозарядные ионы; обычно это катионы слабых оснований. Сильно поляризуются большие по размерам анионы – кислотные остат-ки слабых кислот.
Различают несколько типов гидролиза солей.
1. Соли, образованные сильными основаниями (щелочами) и силь-ными кислотами, не подвергаются гидролизу. Растворы таких солей (NaCl, KNO3, Ва(NO3)2 и др.) имеют нейтральную среду (рH ≈ 7).
2. Соли, образованные сильными основаниями и слабыми кислота-ми, гидролизуются по аниону, так как анион образует с ионами водоро-да слабую кислоту. Cреда раствора в этом случае щелочная (рН > 7):
КСN + H2O HCN + KOH – молекулярное уравнение гидролиза
CN- + HOH HCN + OH-– ионное уравнение гидролиза по аниону
Соли этого типа, образованные многоосновными кислотами, гид-ролизуются ступенчато, например:
1-я ступень: К2СО3 + НОН КНСО3 + КОН
СО + НОН НСО32−3- + ОН-
2-я ступень: КНСО3 + Н2О Н2СО3 + КОН
НСО3- + НОН Н2СО3 + ОН-,
причем гидролиз идет в основном по первой ступени.
3. Соли, образованные слабыми основаниями и сильными кислота-ми, гидролизуются по катиону, так как катион образует с гидроксид-ионами слабое основание. Cреда раствора в этом случае кислая (рН < 7).
NH4Cl + H2O NH4OH + HCl – молекулярное уравнение гидролиза
NH4+ + HOH NH4OH + H+ – ионное уравнение гидролиза по катиону
Соли этого типа, образованные многокислотными основаниями, гидролизуются ступенчато, например:
1-я ступень: ZnCl2 + H2O Zn(OH)Cl + HCl
Zn2+ + HOH Zn(OH)+ + H+
2-я ступень: Zn(OH)Cl + H2O Zn(OH)2 + HCl
Zn(OH)+ + HOH Zn(OH)2 + H+,
причем гидролиз идет в основном по первой ступени.
4. Соли, образованные слабыми основаниями и слабыми кислота-ми, гидролизуются и по катиону и по аниону, например:
NH4CN + H2O NH4OH + HCN
При этом рН среды зависит от силы образующихся слабых кислот и ос-нований (обычно рН равен 6–8). Такие соли гидролизуются в большей степени, чем рассмотренные в п. п. 2 и 3. Гидролиз таких солей проис-ходит практически необратимо, если выделяется газ или осадок либо если то и другое образуется одновременно, например:
Al2S3 + 3H2O = 2Al(OH)3↓ + 3H2S↑
Экспериментальная часть
Целью работы является проведение гидролиза некоторых солей, изучение влияния состава солей и внешних условий на полноту их гид-ролиза.
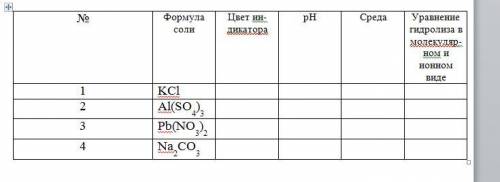
Опыт 1. Определение среды растворов различных солей. На полоску универсальной индикаторной бумаги нанести по одной капле растворов КСl, Al2(SO4)3, Pb(NO3)2, Na2CO3. В каком случае про-текает гидролиз? Определить рН растворов, результаты опыта оформить в виде таблицы:
Ответы
Показать ответы (3)
Другие вопросы по теме Химия
Популярные вопросы
- Тест по теме: Валентность. Вариант 1 1. Элемент, атомы которого всегда...
3 - Мне нужен проверенный ответ который нв 5 и точка...
1 - К краю круглой пластины радиусом R прикреплен шарик массой m. Пластина...
1 - Раскрыть скобки 1.1 I like walking in the park near my home, (TO REGARD)...
3 - Please write 10 sentences about your hobby. Use present simple...
1 - Громадянка Білорусі, що працювала в Україні, народила у пологовому...
3 - 1`.У чотирикутній піраміді SABCD проведено переріз площиною, яка проходить...
3 - Як називають карти, на яких різноманітні географічні об єкти та явища...
3 - He was an English poet during the Middle Ages.Перевод на узбекский...
2 - Даны векторы a=3i-4j+7k и b=6i-8j+k. Найдите координаты вектора c=5a-2b...
3