Электролиз раствора сульфата некоторого металла проводили при силе тока 6 а в течение 45 мин, в результате чeгo на катоде выделилось 5,49 г металла. вычислите эквивалентную массу металла.ответ: 32,7г/моль
Ответы
По закону Фарадея имеем:
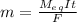 <=>
<=> 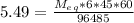 <=>
<=> 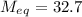 г/моль.
г/моль.
ПОКАЗАТЬ ОТВЕТЫ
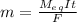 <=>
<=> 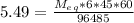 <=>
<=> 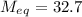 г/моль.
г/моль.
Другие вопросы по теме Химия
Популярные вопросы
- Диалог с вежливыми словами...
1 - Основные задачи послевоенного регулирования в международных отношениях....
3 - 486році Холдвіг розбив війська римлян у битві при Суассоні захопив...
1 - Зробіть синтаксичний розбір речень 1)Мамо,я тебе безмежно люблю...
3 - Нужно написать текст на английском на тему курсов...
1 - А) 50, 105; B145 Г) 55. 7. Прохі Аві со прекарі та перетинаються...
2 - 2. Основание равнобедренного треугольника равно 16,боковая сторона...
3 - Знайдіть sind a, tg a,ctg a якщо COS a...
2 - Найдите значение выражения: 0,012×12000×0,0000012×1200...
2 - Вишні зацвівши, в росах заплачуть....
3