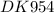Для реакции Al203 (т) + 3 SO3 (г) = Al2(SO4)3 (т) рассчитайте ДН_ AS если ДН°298: ДН°Al2O3(т) = -1676 AH°SO3(r) = -395,2 ДН°Al2(SO4)3 (т) = -3444 если ДS°298: AS° (Al2O3(т)) = -50,9 AS° (SO3(r)) = 256,23 AS° (Al2(SO4)3 (т)) =239

Другие вопросы по теме Химия
Популярные вопросы
- 1027. Если в некоторой десятичной дроби перенести запятую вправорез одну цифру,...
3 - На какаой ступени строится маж 64...
1 - Положить разв язать задачю...
1 - Скласти Есе на тему: На карантині я і наша планета...
3 - D. Choose the correct modal verb. 1. Children mustn’t/ needn’t dive into the river....
2 - Нужно написать Тему, идею и жанр стихотворения Есенина,, До свидание мой друг до...
3 - Автобус и грузовая машина, скорость которой на 17 км/ч больше скорости автобуса,...
3 - числовые последовательности...
2 - Творча обдарованість Лукаша із твору Лісова пісня...
1 - Задача : При изохорном охлаждении 10 моль неона , имеющего начальную температуру...
3
1) Для начал мы запишем уравнение реакций из условия задачи:
Al₂O₃(т.) + 3SO₂(г.) → Al₂(SO₄)₃(т.)
2) Далее мы напишем уравнение для нахождения энтальпий в этой уравнений реакций:
ΔH = ∑Hпр.реак. - ∑Hисх.в-в. = ΔH°₂₉₈(Al₂(SO₄)₃) - (ΔH°₂₉₈(Al₂O₃) + 3ΔH°₂₉₈(SO₂)) = -3444 кДж/моль - (-1676 кДж/моль + 3×(-395,2 кДж/моль)) = -3444 кДж/моль - (-1676 кДж/моль - 1185,6 кДж/моль) = -3444 кДж/моль - (-2861,6 кДж/моль) = -3444 кДж/моль + 2861,6 кДж/моль = -582,4 кДж/моль
3) Теперь находим энтропии в этой уравнений реакций:
ΔS = ∑Sпр.реак. - ∑Sисх.в-в. = ΔS°₂₉₈(Al₂(SO₄)₃) - (ΔS°₂₉₈(Al₂O₃) + 3ΔS°₂₉₈(SO₂)) = 239 Дж/(моль×К) - (-50,9 Дж/(моль×К) + 3×256,23 Дж/(моль×К)) = 239 Дж/(моль×К) - (-50,9 Дж/(моль×К) + 768,69 Дж/(моль×К)) = 239 Дж/(моль×К) - 717,79 Дж/(моль×К) = -478,79 Дж/(моль×К)
ответ: ΔH = -582,4 кДж/моль ΔS = -478,79 Дж/(моль×К)
Решено от :