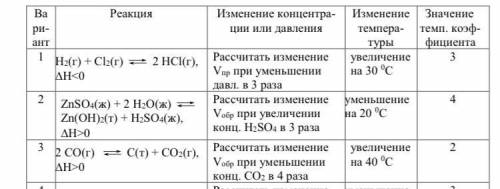
Даны обратимые реакции. Для реакции в Вашем варианте (таблица 2.10) выполните следующие задания:
2.1. Объясните, почему данная реакция является обратимой.
2.2. Определите, в гомогенной или гетерогенной системе проходит данная реакция, и объясните, как Вы это определили.
2.3. Укажите, экзотермической или эндотермической является пря- мая реакция (протекающая в прямом направлении) и почему (во всех вари- антах знак H приведен для прямой реакции).
2.4. Напишите математическое выражение скоростей прямой и об- ратной реакций по закону действующих масс через концентрации, а при наличии в системе газов – и через парциальные давления.
2.5. Определите расчетным во сколько раз (V2/V1) изме- нится скорость прямой или обратной реакции (см. задание в таблице 2.10) при указанном в таблице изменении концентрации или давления (Т=const). Приведите расчет.
2.6. Определите, во сколько раз увеличится (или уменьшится) ско- рость прямой реакции при заданном изменении температуры и значении температурного коэффициента (см. задание в таблице 2.10; в расчете ис- пользуйте правило Вант-Гоффа).
2.7. Укажите, при каком кинетическом условии наступает химиче- ское равновесие, и что позволяет достичь смещения равновесия. Опреде- лите, изменением каких внешних факторов можно сместить химическое равновесие в данной реакции вправо. объясните это с позиций влияния этих факторов на скорости прямой и обратной реакций и с позиций прин- ципа Ле-Шателье.
2.8. Напишите математическое выражение константы равновесия данной обратимой реакции в прямом направлении (через константы скоро- стей прямой и обратной реакций и по закону действующих масс). Объяс- ните, на что указывает значение константы равновесия, и от каких факто- ров она зависит.
вариант 3
Ответы
Показать ответы (3)
Другие вопросы по теме Химия
Популярные вопросы
- N°1368. Выразив переменную у через переменную х, найдите два каких-либо...
3 - Порассуждайте Почему учёные экологи часто говорят что человек ведёт противоестественный...
3 - 5. Самець жаби-бика стежить за рівнем води в пересихаючих ка- люжах, де...
2 - Обязанности несовершеннолетних работников...
3 - У трикутнику перша зі сторін на 5 см довша за другу А третя на 1 см коротша...
1 - 2. Знайдіть рядок зі сполучниками: А. розповів, як дивно; мріяв про відпустку;...
2 - Біологічне значення вродженої поведінки...
2 - Задание №2. Какой легенде посвящен рисунок? Кратко опиши легенду. АМЕНТДескриптор:-...
2 - Определи где возможно форму времени и рода глаголов. 1)обьехал препятствие...
1 - за победу футбольная команда получает 3 очка за ничью одно очко за поражение...
1