50 1.хлоридная кислота прореагировала с кальцием, массой 8,7 г. вычислить массу образовавшейся соли и объем водорода, выделившегося при нормальных условиях. 2..разбавленная сульфатная кислота прореагировала с магнием, массой 5,8 г. вычислить массу образовавшейся соли и объем водорода, выделившегося при нормальных условиях.
Ответы
...........................
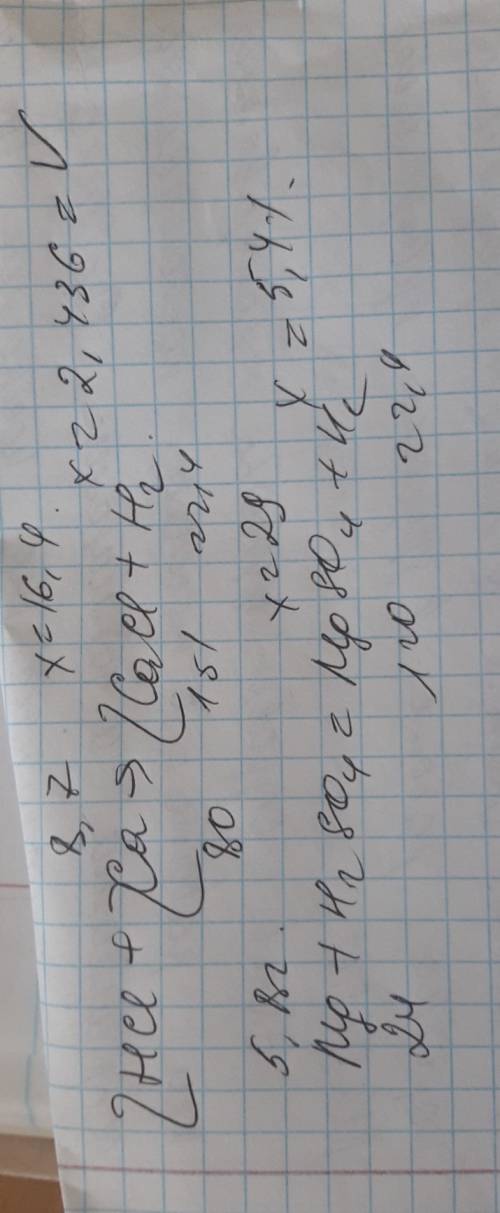
ПОКАЗАТЬ ОТВЕТЫ
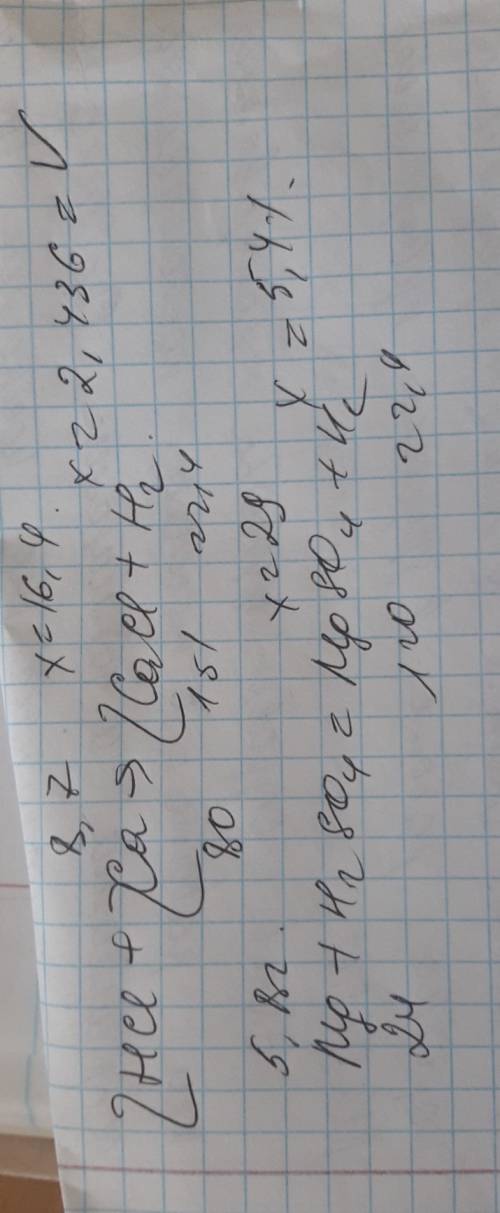
1. Дано:m(Fe2O3) = 40 гНайти: V(H2)Решение:0,25 моль х мольFe2O3 + 3H2 = 2Fe + 3H2O1 моль 3 мольn = m/MM(Fe2O3) = 160 г/мольn(Fe2O3) = 40 г / 160 г/моль = 0,25 моль0,25 = х 1 3х = 0,75n(H2) = 0,75 мольV = Vm * nV(H2) = 22,4 дм3/моль * 0,75 моль = 16,8 дм3 = 16,8 лответ: 16,8 л 2. Дано: m(Mg) = 4,8 гНайти: V(H2)Решение:0,2 моль х мольMg + H2SO4 = MgSO4 + H21 моль 1 мольn = m/MM(Mg) = 24 г/мольn(Mg) = 4,8 г / 24 г/моль = 0,2 моль0,2 = х 1 1х = 0,2n(H2) = 0,2 мольV = Vm*nV(H2) = 22,4 дм3/моль * 0,2 моль = 4,48 дм3 = 4,48 лответ: 4,48 л 3. Дано: m(Zn) = 19.5 гНайти: V(H2)Решение:0,3 моль х мольZn + 2HCl = ZnCl2 + H21 моль 1 мольn = m/MM(Zn) = 65 г/мольn(Zn) = 19,5 г / 65 г/моль = 0,3 моль0,3 = х 1 1х = 0,3n(H2) = 0,3 мольV = Vm*nV(H2) = 22,4 дм3/моль * 0,3 моль = 6,72 дм3 = 6,72 лответ: 6,72 л
ПОКАЗАТЬ ОТВЕТЫ
Другие вопросы по теме Химия
Популярные вопросы
- Мешок массой 20 кг, находящийся на подъемнике, давит на дно подъемника с силой 220...
2 - на русском) Бексултан начертил треугольник АВС и отметил точку пересечения его медиан...
3 - .1.2.2.2.2..1.1.1.1.1..1.1.1.1.1.2..1.1...
3 - плз, Надо что бы за четверть была крепкая 8 ...
3 - Какие изобразительно-выразительные средства передают ужас, который произвёло пение...
2 - Верны ли следующие суждения о многообразие форм человеческих знаний? А.Только научное...
2 - Перечислите профессионаизмы риэлтораНапример, шофёр :баранка, стукач, огрызок...
1 - Скільки електронів може приєднати атом фтору?...
3 - 2. Поміркуйте, чому розповідь у пісні ведеться від першої особи. 3. Поясніть, який...
2 - Складіть структурну формулу 2-метил-3-пентанолу...
2