1. во сколько раз увеличится скорость реакции при повышении температуры от 150о до 200о, если температурный коэффициент равен 3. 2. как изменится скорость реакции: co(г)+cl ₂ (г) →cocl2(г)+q , если повысить давление в 3 раза. 3. куда сместится равновесие реакции co(г)+cl ₂ (г) →cocl2(г)+q если: · увеличить концентрацию со · уменьшить температуру · повысить давление
Другие вопросы по теме Химия
Популярные вопросы
- 1) 8029 = _ см , 2) 3 км 200м = _ см , 3) 20к 8 м 9 дм 6 см = _ см ?...
1 - Напишите только число в двоичной системе и ответ. сколько единиц в двоичной записи...
1 - Диалогтерді толықтырып айтыңдар. -біз ұшаққа билетке тапсырыс берсек деп едік....
1 - Не большое предложение к слову одиннадцать...
2 - Состоятельные горожане занимающиеся предпринимательской деятельностью заранее...
2 - На тело, имеющее массу 4 кг, действует постоянная сила f = 6 н, направленная в...
1 - Придумай . стоят весы и написано 19 кг. на весах одна сумка 6 кг, вторая 3 кг,...
3 - (74,7*2|21+(-105,3)*2 3|,3)*2|21-2 3|7*74,7)/10 розвяжіть будласка...
3 - Нужно текст! на тему острые предметы это- !...
1 - Изучая язык, студент каждый день учит столько слов, сколько за два предыдущих...
3
Задача №1
Для решения такой задачки, воспользуемся формулой:
Получаем:
ответ6 скорость реакции возрастет в 243 раза(не хило)
Задача №2
Запишем уравнение:
- Запишем кинетическое уравнение для данной реакции:
Пусть
Запишем кинетическое выражение реакций до увеличения давления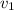 и после
и после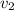 :
:
Теперь разделим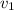 на
на 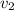
Сокращаем и получаем, что скорость реакции возрасла в 9 раз
ответ: скорость реакции возрастет в 9 раз(тут вроде более менее:DD)
Задание №3
Увеличивая концентрацию угарного газа мы смещаем равновесие в сторону продуктов реакции т.е. ->
Уменьшая температуру, мы смещаем равновесие в сторону продуктов реакции, т.е. ->
Увеличение давления сместит равновесие в сторону продуктов реакции, т.е. ->, т.к. число моль газов в правой части меньше, чем число моль газов в левой части
Вот так))