1.У атомов неметаллов, в отличие от атомов металлов того же периода: 1) больше электронных пар;
2) меньше заряд ядра;
3) сильнее притяжение валентных электронов в ряду;
4)больший атомный радиус.
2.В ряду неметаллов S→Se→Te:
1) ослабевает притяжение валентных электронов ряду;
2) усиливаются неметаллические свойства;
3) увеличивается электроотрицательность;
4)уменьшается число валентных электронов.
3. Химическая связь в молекуле фтора:
1) ионная;
2) водородная;
3) ковалентная полярная;
4) ковалентная неполярная.
4.Сера имеет степень окисления +4 в соединениях, формулы которых:
1) K2S, SO3, H2SO3;
2) SO2; K2SO3; NaHSO3;
3) H2SO4; SCl4; SO2;
4)KHSO4, SO3; K2SO4.
5.Установите соответствие:
Простое вещество
А. Алмаз
Б.Графит
В.Белый фосфор
Тип кристаллической решетки
1.Молекулярная
2.Ионная
3.Атомная
4.Металлическая
Часть 2.
6. С какими из перечисленных веществ будет реагировать с разбавленной серной кислотой: гидроксид калия, алюминий, нитрат бария, оксид серы(IV), оксид железа(III), медь, гидроксид цинка? Напишите уравнения осуществимых реакций (два из них в ионной форме).
7.Составьте электронный баланс для реакции и подберите коэффициенты:
Сu + H2SO4(безводн.) → Сu2SO4 + …. + 2H2O
Часть 3
8.Напишите уравнения реакций, с которых можно осуществить следующие превращения:
(Фото вначале)
9.Какой объем (н.у.) углекислого газа можно получить при термическом разложении 200 г известняка, содержащего 20% примесей.
10. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
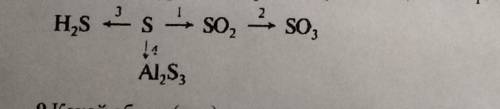
Другие вопросы по теме Химия
Популярные вопросы
- тело переместилось из точки А с координатой -24 м в точку В с координатой 14...
1 - Химия . Решить эти задачи....
3 - Тест по истории России Общественное движение при Александре I. Выступление...
2 - Найдите площадь треугольника...
3 - №1 Дано: - напряжение на выведенных концах Uвх = [В]; - Найти силу тока I1,...
3 - 5.Сабақ сөзінің бірінші буыны қандай? а.тұйық ә.ашық б.бітеу в.жіңішке...
3 - Нужно зазделить фигуру на 5 равных частей. Равными они будут считаться если...
1 - К аккумулятору напряжением 10В подключена лампочка мощностью 6Вт. Чему равен...
3 - 1.44. Найдите значение выражения: i+ при т = -25, c = 7....
2 - Задание 2 . Определите модель предложений в тексте, тип информации, заложенной...
1
Объяснение:
У атомов неметаллов в одном периоде больше электронных пар, потому что неметаллы имеют большее количество электронов в своей валентной оболочке, чем металлы.
Ответ: 1) больше электронных пар.
2.В ряду неметаллов S→Se→Te:
Объяснение:
В ряду неметаллов S→Se→Te происходит увеличение атомного радиуса и увеличение числа валентных электронов. Это приводит к ослаблению притяжения валентных электронов ряду.
Ответ: 1) ослабевает притяжение валентных электронов ряду.
3. Химическая связь в молекуле фтора:
Объяснение:
Молекула фтора содержит ковалентную полярную связь. Ковалентная связь образуется из-за общего использования электронных пар атомами фтора, при этом атома фтора с большей электроотрицательностью привлекает электронную плотность к себе, что делает связь полярной.
Ответ: 3) ковалентная полярная.
4.Сера имеет степень окисления +4 в соединениях, формулы которых:
Решение:
Для определения степени окисления серы в данном соединении необходимо рассмотреть окислительный и восстановительный агенты в реакции. Так, SO2 реагирует с K2SO3 и NaHSO3 в соответствующих соотношениях и при этом показывает степень окисления +4. Поэтому правильный ответ - 2) SO2; K2SO3; NaHSO3.
5.Установите соответствие:
Простое вещество Тип кристаллической решетки
А. Алмаз 1.Молекулярная
Б.Графит 3.Атомная
В.Белый фосфор 2.Ионная
Ответ:
А. Алмаз - 1. Молекулярная
Б. Графит - 3. Атомная
В. Белый фосфор - 2. Ионная
6. С какими из перечисленных веществ будет реагировать с разбавленной серной кислотой: гидроксид калия, алюминий, нитрат бария, оксид серы(IV), оксид железа(III), медь, гидроксид цинка? Напишите уравнения осуществимых реакций (два из них в ионной форме).
Решение:
Первым шагом необходимо определить, с какими из перечисленных веществ произойдут химические реакции с разбавленной серной кислотой. Затем, для каждого вещества напишем уравнение реакции.
Алюминий (Al) реагирует с разбавленной серной кислотой (H2SO4) с образованием соли (алюминия сульфата) и выделением водорода (H2):
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
Медь (Cu) реагирует с разбавленной серной кислотой (H2SO4) с образованием соли (меди(II) сульфата) и выделением диоксида серы (SO2) и воды (H2O):
Cu + H2SO4 → CuSO4 + SO2↑ + 2H2O
Ответ:
а) Алюминий: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
б) Медь: Cu + H2SO4 → CuSO4 + SO2↑ + 2H2O
7.Составьте электронный баланс для реакции и подберите коэффициенты:
Сu + H2SO4(безводн.) → Сu2SO4 + …. + 2H2O
Решение:
Прежде всего, сбалансируем атомы металла (меди) и кислорода:
Cu + H2SO4(безводн.) → Cu2SO4 + H2O
Далее, сбалансируем атомы водорода:
Cu + H2SO4(безводн.) → Cu2SO4 + 2H2O
Итоговый электронный баланс:
Cu + H2SO4(безводн.) → Cu2SO4 + 2H2O
Часть 3
8.Напишите уравнения реакций, с которых можно осуществить следующие превращения:
В данном случае приведено изображение схемы реакции, однако, по описанию невозможно определить какие реакции требуются для осуществления превращений. Пожалуйста, предоставьте дополнительную информацию о реакциях, которые необходимы для решения данного задания.
9.Какой объем (н.у.) углекислого газа можно получить при термическом разложении 200 г известняка, содержащего 20% примесей.
Решение:
Для решения данной задачи необходимо использовать знание о составе и стехиометрии реакции термического разложения известняка (CaCO3):
CaCO3 → CaO + CO2
Молярная масса CaCO3 = 40 + 12 + (3 * 16) = 100 г/моль
Пересчитаем массу известняка в количество вещества, используя формулу:
количество вещества = масса / молярная масса
количество вещества CaCO3 = 200 г / 100 г/моль = 2 моль
Также известно, что каждый моль CaCO3 разлагается на 1 моль CO2, поэтому количество CO2, получаемого при термическом разложении 2 моль CaCO3, будет равно 2 моль.
Для конечного вычисления объема углекислого газа (н.у.) необходимо использовать уравнение состояния идеального газа PV = nRT, где P - давление, V - объем, n - количество вещества, R - универсальная газовая постоянная и T - температура.
В стандартных условиях (н.у.) давление равно 1 атм, температура равна 273 К, а универсальная газовая постоянная равна 0,0821 атм * л / (моль * К).
Таким образом, подставим известные значения в уравнение и решим относительно объема:
1 * V = 2 * 0,0821 * 273
V = (2 * 0,0821 * 273) / 1
V = 44,62 л
Ответ: объем углекислого газа, получаемого при термическом разложении 200 г известняка, составляет 44,62 л (нормальных условий).
10. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
Решение:
Сначала нужно найти количество вещества сульфата алюминия в растворе. Для этого воспользуемся массовой долей:
масса сульфата алюминия = 68,4 г
массовая доля сульфата алюминия = 8%
количество вещества сульфата алюминия = (68,4 г * 0,08) / молярная масса сульфата алюминия
Молярная масса сульфата алюминия: Al2(SO4)3 = 2 * (27) + 3 * (32 + 16*4) = 342 г/моль
количество вещества сульфата алюминия = (68,4 г * 0,08) / 342 г/моль = 0,016 моль
Далее, используя уравнение реакции нейтрализации между сульфатом алюминия (Al2(SO4)3) и хлоридом бария (BaCl2), можно найти соотношение между количество вещества сульфата алюминия и осадка бария сульфата (BaSO4):
Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4
Исходя из стехиометрии реакции, соотношение между Al2(SO4)3 и BaSO4 1:3. Это означает, что при реакции каждый моль Al2(SO4)3 образует 3 моля BaSO4.
Итак, количество вещества BaSO4, образующегося из Al2(SO4)3: количество вещества BaSO4 = 3 * количество вещества Al2(SO4)3 = 3 * 0,016 моль = 0,048 моль
Наконец, используя молярную массу BaSO4 (233 г/моль), найдем массу образовавшегося осадка:
масса осадка = количество вещества * молярная масса = 0,048 моль * 233 г/моль = 11,3 г
Ответ: Масса образовавшегося осадка составляет 11,3 г.