1)рассчитать массу карбида алюминия,полученную при взаимодействии 3,6 грамм углерода с избытком алюминия 2)рассчитать массу известняка(массовая доля карбоната кальция 80%),которую надо взять для получения 112 литров
углекислого газа 3)при взаимодействии соляной кислоты на смесь карбоната кальция и оксида кальция масса равна 30 грамм,выделится газ объемом 5,6 литров.рассчитать массовую долю ca2co3 в смеси
Другие вопросы по теме Химия
Популярные вопросы
- надо составить с этими словосочетаниями предложения о себе или о ком- то ещё (...
3 - Составьте словосочетаний : биатлон, кемпинг, внучка, бюрократ, фехтование, автомат,...
3 - 99 9 9 9 9 9 9=1998 поставьте между числами + или - так, чтобы вышел такой ответ....
1 - Как по-другому можно назвать чувствительный и двигательный нерв?...
2 - Объяснить пословицу бог долго ждет, да больно бьет у этого сайта нет рейтинга...
3 - 1)какое число надо умножить на 4,чтобы получить разность числе 350 и 70? 2)на какое...
3 - Морфологический разбор слова удержишь? надо...
3 - Укажите главное отличие водное среды жизни от наземно-воздушной...
2 - Вообще не врубаюсь! боковое ребро пирамиды, основание которой - прямоугольник,...
2 - Complete these sentences. use friend (s) of mine/yours etc. 1. i went to the cinema...
2
n(C)=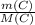 =
=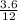 =0.3 моль
=0.3 моль
Из уравнения реакции следует, что n(C)=3n(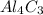 ) =0.1 моль
) =0.1 моль
m(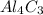 ) =M(
) =M(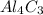 )*n(
)*n(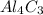 )=144г/моль*0.1 моль=14.4 г
)=144г/моль*0.1 моль=14.4 г