1.прирастворении в соляной кислоте 25,8 г сплава выделилось 2,24 л водорода (н.у). какие массовые доли меди и цинка в этом сплаве составляют(%)(честно говоря,не фига не поняла.) 2. масса марганца,восстановленного из 84 г
оксида марганца (4) аллюминием
Другие вопросы по теме Химия
Популярные вопросы
- 1.Прочитайте предложения, соблюдая правильную интонацию. Охарактеризуйте...
2 - Бүркіт сөзіне бес жолды өлең 1зат есім Бүркіт2Сын есім 2еу3етістік...
2 - 1-тапсырма: (Оқулықтың 129-беті) Мәтінді оқы. Мәтіндегі тұрақты тіркестерді...
2 - Что означает понятие социальной сети...
3 - Прочтите и выполните упражнение 78. Найдите разделы и подчеркните...
3 - Значение растений в природе и в жизни человека? Напишите не более...
1 - 6. Спиши. Вставь пропущенные буквы. Подчеркни подлежащее и сказуемое...
2 - Чим був обумовлений перехід від НЕПу до індустріалізац...
3 - Установіть відповідність між художнім образом та назвою твору 1.Смаглява...
2 - Қажымұқан Мұңайтпасов хронологиялық кесте комек...
3
х г 2,24 л
1.
65 г 22,4 л
1) Так как медь с соляной кислотой не взаимодействует,а будет взаимодействовать цинк,вот его-то массу и найдем по объему выделившегося водорода:
при взаимодействии 65 г цинка выделяется 22,4 л, а
при -- // -- // -- х г__________________2,24 л, откуда
х=65*2,24/22,4=6,5 г
2) Если эту массу отнести к массе всего образца,то узнаем массовую долю цинка в сплаве:
w(Zn)=m(Zn)/m(сплава)=6,5/25,8=0,25 или 25%
3) А на медь приходится: 100% - 25% = 75%
84 г х г
2.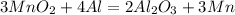
261 г 165 г
при взаимодействии 261 г оксида восстанавливается 165 г марганца, а
при -- // -- // -- 84 г_________________________х г, откуда
х=84*165/261= 53 г