1.напишите уравнения реакций, с которых можно осуществить следущие превращения. p-> mg3p2-> ph3-> p2o5-> h3po4-> ca3(po4)2 2.используя метод электронного , составить уравнение реакции, протекающей по схеме: p+hno3+h2o--> h3po4+no ↑ 3. сколько киллограмов 80%-й фосфорной кислоты можно получить из 31 кг фосфора, содержащего 5% примесей? кто
Другие вопросы по теме Химия
Популярные вопросы
- Как правильно записать глагол а скобках i (to have) a very good time last...
2 - Вледниковый период на земле в пещерах жили пещерные медведи. найдите главные...
3 - Провідміняти на російській мові числівники 888,1785, 149, 133, 443, 740 ,985,...
1 - Оносительно молекулярная масса молекулы бертолетовой соли равна: а)122 б)122,5...
3 - Почему лучше иметь открытого врага чем закрытого 15 и поясните почему так...
3 - Как в квадрате добавить две палочки чтоб получилось два квадрата...
3 - Расставьте знаки препинания и объясните их. золотое перо академика столь...
3 - Решите с дано ! какой объем водорода (н.у) выделится при действии на 5,4...
1 - Все словосочетания в предложении на полянке под осиной вырос подосиновик....
1 - Из предложений 15—17 выпишите слово, в котором правописание приставки зависит...
1
1.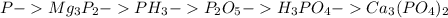
1)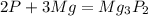
2)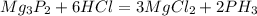
3)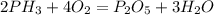
4)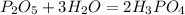
5)
2.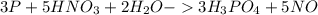
окисление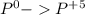 (-5e) восстановитель |5|3
(-5e) восстановитель |5|3
восстановление (+3e) окислитель |3|5
(+3e) окислитель |3|5
3. Дано:
m(P)=31кг
________________________________
m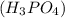 =?
=?
0,2 x
3кмоль 3кмоль
mчист.(P)=31кг*0,2=6,2кг
n(P)=6,2кг/31кг/кмоль=0,2кмоль
m(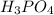 )=0,2кмоль*98кг/кмоль=19,6кг
)=0,2кмоль*98кг/кмоль=19,6кг
m(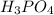 )=19,6кг*08=15,68 кг
)=19,6кг*08=15,68 кг
ответ: 15,68кг