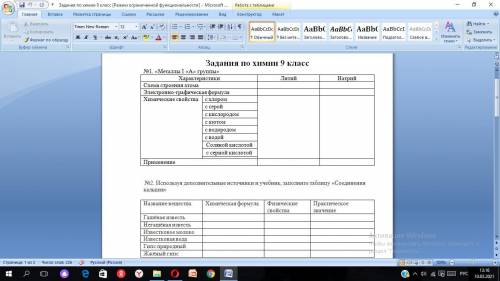
№1. «Металлы I «А» группы» Характеристики Литий Натрий
Схема строения атома
Электронно-графическая формула
Химические свойства с хлором
с серой
с кислородом
с азотом
с водородом
с водой
Соляной кислотой
с серной кислотой
Применение
№2. Используя дополнительные источники и учебник, заполните таблицу «Соединения кальция»
Название вещества Химическая формула Физические свойства Практическое значение
Гашёная известь
Негашёная известь
Известковое молоко
Известковая вода
Гипс природный
Жжёный гипс
№3. Составьте уравнения реакций для осуществления следующих превращений:
Ca -> CaO -> Ca(OH)2 -> CaCO3 -> CaO -> CaCl2 -> Ca3(PO4)2
Уравнение последней реакции запишите не только в молекулярном, но и в ионном виде.
№4. Дайте характеристику КАЛЬЦИЮ по плану:
1. Положение в ПСХЭ
2. Строение атома
3. Физические свойства
4. Получение
5. Химические свойства (запишите УХР кальция с кислородом, серой, соляной кислотой, водой, водородом, хлором)
6. Применение кальция.
№5. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
№6. Закончите уравнения химических реакций:
Al + H2SO4 (раствор) ->
Al + CuCl2 ->
Al + HNO3(конц) -t->
Al + NaOH + H2O ->
№7. Осуществите превращения:
Al -> AlCl3 -> Al -> Al2S3 -> Al(OH)3 -t->Al2O3 -> Al
1) Al -> Al(OH)3 -> AlCl3 - > Al(OH)3 > Na[Al(OH)4] -> Al(OH)3 -> AlCl3
Ответы
Показать ответы (3)
Другие вопросы по теме Химия
Популярные вопросы
- За день в магазине было продано 9одинаковых ящиков с печеньем.до обеда пррдали162кг...
2 - Вкниги 48 стр. в первый день юля прочитала 8 стр., во второй-в2 раза больше стр....
2 - Сравнить положение северного кавказа и урала, четко структурировать сходство и...
1 - Тело движется вдоль координатной оси. в начальный момент времени направление скорости...
2 - Отличия агроценозов от биогеоценозов...
3 - Найдите нок 5; 20; 15; 25; 2. , надо!...
2 - Воду какой массы можно нагреть от 20°с до кипения, если ей сообщить энергию, равную...
1 - У=х+ln(2x+1) - выяснить при каких х значения производных функций обращается в...
2 - Сочинение по картине а. н. комарова наводнение ....
2 - Нужна ли запятая в предложении.на улице тает снег,и бегут ручьи....
2