1) какая масса водорода, содержащего 1*10^23 молекул? 2) вычислите массовую долю хлора в водном кристаллогидрате хлорида кальция. 3) оксид магния массой 10 г обработали раствором, содержащим 49 серной кислоты. сколько граммов соли образовалось? 4) запишите электронную формулу атома алюмения. сколько протонов, нейтронов, электронов содержится в этом атоме. 5) какой из оксидов является основным 1)clo3; 2)no2; 3)p2o5; 4)cuo 5)co2 6) какой из веществ может образовать кислую соль: 1)нвг 2)naoh 3)h2co3 4)hcl 5)hno3.
Другие вопросы по теме Химия
Популярные вопросы
- выпешите слова в которые нужно вставить букву Воспользуйтесь...
3 - Что можно приготовит из картошки?...
3 - Скільки коренів має рівняння cos2x= кубічний корінь -1,1...
2 - Інтервально-акордову послідовність в B-dur...
2 - Написать три конфліктні ситуації які можна вирішити мирним шляхом...
2 - Постройте график прямой пропорциональности: 1) y=3/4x(это дробь)...
3 - Осодка судна у воді визначаються :а. повною лінієюб. ватерлінією...
1 - Уақытында сөз табы талдау !! НЕ ПИШИТЕ ЕРУНДУ!...
2 - Знайдіть область визначення функцій y= 2x³+1 ...
1 - Група умовних рефлексів ,що виробляються на природні безумовні...
2
1)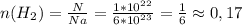 моль
моль
ответ: 0,34г
2) формула: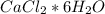
ответ: 64%
3)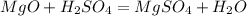
1. Через массы вычисляем количество моль и узнаём, какое из них в избытке и какое в недостатке. Через недостаток можно будет найти массу соли, а избыток просто отбрасываем:
Значит, решаем через оксид магния.
2. Зная коэффициенты в уравнении, можно составить соотношение и узнать количество моль соли:
3. Зная количество моль соли, можно найти её массу:
ответ: 30г
4) Во вложении смотри.
5) вариант 4 -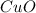
6) вариант 3 -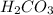 , т.к многоосновная кислота.
, т.к многоосновная кислота.