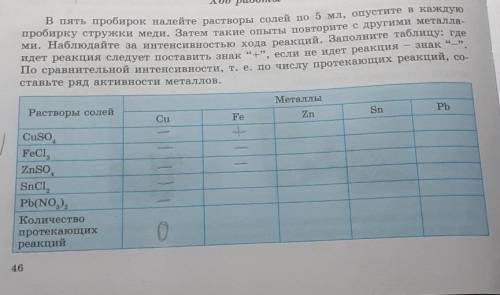
В пять пробирок налейте растворы солей по 5 мл, опустите в каждую пробирку стружки меди. Затем такие опыты повторите с другими металла-
ми. Наблюдайте за интенсивностью хода реакций. Заполните таблицу: где
идет реакция следует поставить знак “+”, если не идет реакция знак "-".
По сравнительной интенсивности, т. е. по числу протекающих реакций, со-
ставьте ряд активности металлов.
Металлы
Растворы солей
Cu
Fe
Zn
Sn
Pb
Cuso
FeCI ,
ZnSO
SnСІ,
Pb(NO3)2
Количество
протекающих
реакций
0
46
Другие вопросы по теме Геометрия
Популярные вопросы
- 38.При якому значенні параметра а рівняння ax2+(a2−1)x+5 = 0 має корені...
2 - Подайте у вигляді многочлена...
3 - как называется ориентация, когда тебе нравятся и женщины, и мужчины...
3 - План анализа: 1. Автор и название произведения 2. О чём это произведение?...
2 - По данным отглоссированным примерам определите, являются ли слова, которые...
2 - Решите уравнение |50,5-х в квадрате| =49,5 Номер 9 из фото...
3 - Задание на картинке вот текст 8 части ОЧЕНЬ буду очень благодарна))...
1 - Ученые-биологи всем заранее! (биология) 1. К научным предпосылкам возникновения...
3 - 1. Электролиттер және бейэлектролиттер деген не? Екі мысалдан келтіріңдер...
1 - На карте стрелками отмечены два города. Запиши встроке ответа названия...
1
1. В первой пробирке наливаем раствор соли меди (CuSO4) объемом 5 мл.
2. Опускаем в первую пробирку стружки меди (Cu).
3. Наблюдаем за интенсивностью хода реакции в первой пробирке и заполняем соответствующую ячейку в таблице. Если реакция происходит, ставим знак "+" в ячейку, если нет реакции, ставим знак "-".
4. Повторяем эксперименты с растворами солей других металлов (Fe, Zn, Sn, Pb) по аналогии с первым экспериментом.
5. Заполняем таблицу значениями "+" или "-" в соответствии с результатами наблюдений каждого эксперимента.
6. По количеству протекающих реакций мы можем составить ряд активности металлов. Чем больше протекающих реакций, тем более активным металлом он является.
Вот таблица с заполненными значениями:
Металлы | Растворы солей | Количество протекающих реакций
------------------------------------------------
Cu | CuSO4 | 0
Fe | FeCl2 | 4
Zn | ZnSO4 | 6
Sn | SnCl2 | 4
Pb | Pb(NO3)2 | 6
Итак, по полученным результатам мы можем составить ряд активности металлов:
Самым активным металлом является цинк (Zn), так как с ним произошло наибольшее количество протекающих реакций. Затем идет свинец (Pb), затем железо (Fe), становится неактивным металлом медь (Cu), и наименее активным металлом является олово (Sn).
Это объясняется электрохимической активностью металлов. Металлы с большей активностью имеют большую склонность отдавать электроны, что позволяет им реагировать с растворами солей и образовывать ионы металла в растворе. Металлы с меньшей активностью имеют меньшую склонность оставаться в ионной форме и поэтому не реагируют с растворами солей.