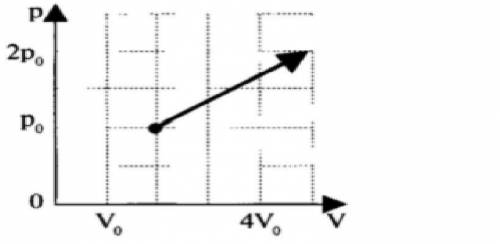
На рV — диаграмме изображен процесс перевода газа, совершенный с одним молем идеального одноатомного газа. Чему равно количество теплоты, переданное газу при переходе из состояния 1 в состояние 2? р0 = 0,1 МПа, V0 = 2 л.
Другие вопросы по теме Физика
Популярные вопросы
- На вязания трёх свитеров израсходовали 276 м шерстяной нити. сколько...
2 - Решить уравнения: 6x-15=0; 10(3x-2)-3(5x+2)+5(11-4x)=25...
3 - Заполните таблицу повреждения скелета и первая...
3 - Переведите одно сволосочитание: үрмелі аспап...
2 - Выполните морфемный разбор слов: опавшими; поседели...
2 - 30 слов с ,,н и ,,нн действительные и страдательные.в настаящем времени...
1 - Вода растворяет сахар,поваренная соль,пищевую соду,стиральный порошок,мыло....
3 - Укажите слова с буквой (о) в корнях с чередованием о\\а 1) подг..релый...
3 - Выписать выделенные слова и пользуясь алгоритмом ,обозначить окончания....
1 - Какие металлы имеют постояную степень окисления...
2
Q = Cv ΔT
где Q - количество теплоты, переданное газу, Cv - молярная удельная теплоемкость газа при постоянном объеме, ΔT - изменение температуры газа.
Дано, что газ является идеальным одноатомным газом. Для такого газа молярная удельная теплоемкость при постоянном объеме выражается как Cv = (3/2)R, где R - универсальная газовая постоянная.
Также дано, что процесс перевода газа из состояния 1 в состояние 2 представлен на рV-диаграмме. Из диаграммы видно, что процесс представляет собой изобарное сжатие газа.
Используя известные значения и формулы, приступим к решению задачи.
1. Определим начальное и конечное давление газа.
Из условия задачи известно, что р0 = 0,1 МПа (мегапаскали) - начальное давление газа.
На рV-диаграмме видно, что состояние 2 соответствует точке с координатами (3л, 0,04МПа). Это значит, что конечное давление газа равно 0,04 МПа.
2. Определим начальный и конечный объем газа.
Из условия задачи известно, что V0 = 2 л (литра) - начальный объем газа.
На рV-диаграмме видно, что состояние 2 соответствует точке с координатами (3л, 0,04МПа). Это значит, что конечный объем газа равен 3 л.
3. Определим изменение температуры газа.
Мы знаем, что процесс представляет собой изобарное сжатие газа. По определению изобарного процесса, давление газа остается постоянным.
ΔT = T2 - T1
В идеальном газе изменение температуры связано с изменением объема. Так как у нас дано изобарное сжатие, то температура газа пропорционально изменяется с объемом.
ΔT = (V2 - V1) / V0 * T0
ΔT = (3 л - 2 л) / 2 л * T0
ΔT = (1 л) / 2 л * T0
ΔT = 0,5T0
4. Подставим известные значения в формулу для вычисления количества теплоты:
Q = Cv ΔT
Q = (3/2)R * 0,5T0
В данной задаче мы не знаем температуру газа, но нам дана возможность найти ее, воспользовавшись уравнением состояния идеального газа:
PV = nRT
где P - давление газа, V - объем газа, n - количество вещества (моль), R - универсальная газовая постоянная, T - температура газа.
Для одноатомного идеального газа число степеней свободы равно 3. Используя это, мы можем выразить температуру газа через начальное давление и объем:
T0 = (P0 * V0) / (nR / F)
T0 = (0,1 МПа * 2 л) / (1 моль * 8,314 Дж/(моль*К) / 3)
T0 = (0,2 МПа * 3 л) / (8,314 / 3)
T0 = (0,6 MPa * l) / (8,314 / 3)
T0 = (0,6 MPa * l) / (2,771333333333333)
T0 ≈ 0,216 К
Подставим найденное значение температуры в формулу для вычисления количества теплоты:
Q = (3/2)R * 0,5 * 0,216 К
Q ≈ (3/2) * 8,314 Дж/(моль*К) * 0,108 Дж/моль
Q ≈ 0,162 Дж
Таким образом, количество теплоты, переданное газу при переходе из состояния 1 в состояние 2, примерно равно 0,162 Дж.