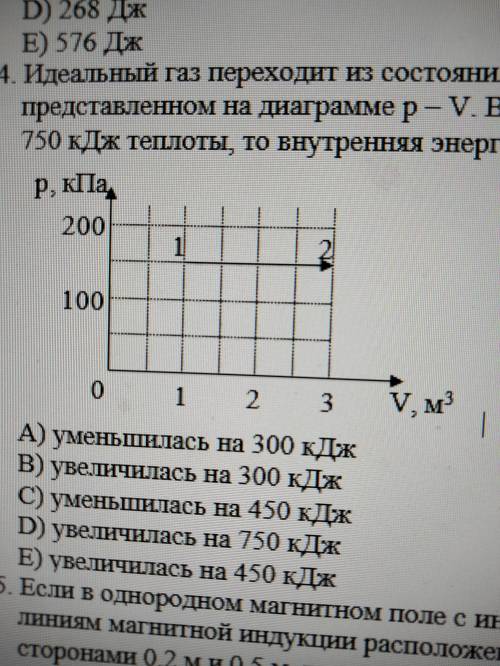
Идеальный газ переходит из состояния 1 в состояние 2 в процессе, представленном на диаграмме p – V. В этом процессе если газ получил 750 кДж теплоты, то внутренняя энергия
Другие вопросы по теме Физика
Популярные вопросы
- Ученик изготавливает на 6 деталей в час меньше, чем мастер. ученик работал...
2 - Всем! напишите, , признаки лютеранской и кальвинистской...
3 - Мына суреттерді салыстыра отырып, салыстырмалы шырай жасандар. отбасыларында...
3 - Очем можно написать в проэкте созвездие вашего ребенка мой ребенок нарисовал...
3 - 24,936 : 24 и 0,748 умножить на 18 (все 2 примера нужно решить в столбик)...
2 - Как кинуть человека на прогиб подробно! если можно подробно !...
1 - Какая была наука в древнем египте? нужно...
2 - Решить купили д пачек бумаги по к листов в каждой .истратили в листов .сколько...
3 - Фазы становления личности 8 класс обществознание...
1 - Синтаксический разбор предложения это маленькое полотно - сокровище третьяковской...
1
Первый закон термодинамики гласит, что изменение внутренней энергии газа равно полученной газом теплоте минус проделанная работа над газом.
Из диаграммы p-V мы можем определить проделанную работу, используя площадь под кривой процесса на диаграмме. В данном случае, площадь можно разделить на две части - прямоугольник и треугольник.
Площадь прямоугольника равна произведению давления и изменения объема газа:
Площадь прямоугольника = p*(V2-V1)
Площадь треугольника можно рассчитать как половину произведения основания (V2-V1) и высоты (p2-p1):
Площадь треугольника = 0.5*(V2-V1)*(p2-p1)
Итого, полная проделанная работа равна сумме площади прямоугольника и треугольника:
Проделанная работа = p*(V2-V1) + 0.5*(V2-V1)*(p2-p1)
Теперь мы можем рассчитать изменение внутренней энергии газа:
ΔU = Q - W
ΔU = 750 кДж - (p*(V2-V1) + 0.5*(V2-V1)*(p2-p1))
К сожалению, для полного решения вопроса требуется конкретное значение давления и объема газа в состояниях 1 и 2, а также уравнение состояния газа. Без такой информации, невозможно расчитать точное изменение внутренней энергии.