Газ в сосуде находится под давлением 2 • 10 ^ 5 па при температуре 127 'с. определите давление газа после того, как половину массы газа было выпущено из сосуда и температура снижена на 50 с.
Другие вопросы по теме Физика
Популярные вопросы
- Причины и поражающие факторы пожаров подробно. ...
2 - Каково сопротивление алюминиевой проволоки длиной 10 м и диаметром 3 мм. Обнаружено,...
1 - 8. Укажите истинность или ложность утверждений о хозяйстве восточных славян. Истина...
3 - VOCABULARY The months and seasons 4 Complete the sentences. 1 In Ja and Fe I visit...
2 - Для дурнів закон не писаний. Ледареві норма не вказана. Силуване - не милуване....
1 - Вычислите: (1+2+...+399)-(1+2+...+199)...
2 - 1) Вычислить используя свойство четности cos(-п/4)+3sin(-п/2)+tg2п 2)Вычислить...
3 - Предложение со словом мовзалей...
3 - ПОПС ФОРМУЛА турецкий гамбит...
1 - Складіть одне речення ускладнене однорідними членами при яких є узагальнувальне...
3
Газ в сосуде -значит, что объем не меняется. Будем использовать уравнение Менделеева-Клайперона.
Состояние 1
P1V=v1RT1 (1)
P1=2*10^5 Па
T1=127+273=400 K
Состояние 2
P2V=v2RT2
P2V=v1/2*RT2 (2)
T2=T1-50=350 K
v2=1/2v1
Делим первое на второе и получаем:
P1V/P2V=v1RT1/v1/2*RT2 - сокращаем и у нас остаётся:
P1/P2=2*T1//T2
P2=Р1*T2//2*T1. Дальше уже решаем численно:
P2 =2*10^5*350/2*400=0,875*10^5 Па = 87 кПа Соответственно... давление конечно понизилось.
Дано:
P=2*10^5 Па.
T1=127 С=400 К. (127+273К=400К).
m2=m1/2;
T2=T1-50 С=127-50=77 С=350 К.
P2=?
_____
Решение:
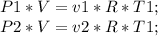
Запишем уравнение Менделеева - Клапейрона для двух случаев:
Объем сосуда не меняется. v1 и v2 - молярные массы газов.
Формулы которых:
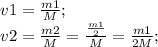
Подставляем, и делим первое уравнение на второе:
Считаем:
P2=(2*10^5*350)/(2*400)=(2*10^5*350)/800=87500 Па=87,5 кПа.
ответ: P2=87,5 кПа.