Найди массу продукта реакции, если алюминий полностью прореагировал с 4 г кислорода, а отношение масс алюминия и кислорода в полученном веществе равно 9:8.
Вычисления производи с точностью до десятых.
Другие вопросы по теме Химия
Популярные вопросы
- Хлороводень об ємом 2,24 літри у воді масою 100г...
1 - Используя данные таблицы, найди температуру насыщения водяного...
2 - Теорема о площади треугольникарис. 11.26 - 11.28 1-7...
2 - известно что числа 4,х-3, sin(arcsinx),взятые в указанном порядке...
3 - Вставить пропуски. we are having a great time on this holiday....
2 - 1.найти прозводную сложной функции z=e^(y-2x+2); x=sin t y= cost...
2 - Каждую из 3 книг наугад кладут в 1 из 5 ящиков. найдите вероятность...
1 - Направление арабской культуры. (на каждую ячейку по 3) 30 !...
1 - Проведи эксперимент и выясни при каких условиях хранения хлеб...
2 - Соч сравните цели, целевую аудиторию, жанровые и стилистические...
1
ответ: 4,5 г
Объяснение:
4Al + 3O₂ = 2Al₂O₃
так как оба вещества полностью прореагировали, то их молярные количества (алюминия и кислорода) относятся как 4:3
n(O₂) = 4г / 32 г/моль = 0,125 моль
то n(Al)=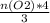 =
= 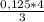 ≈ 0,167 моль
≈ 0,167 моль
m(Al)= M(Al) × n(Al) = 27 г/моль × 0,167 моль ≈ 4,5 г
соотношение алюминия и кислорода в продукте равно 9:8. Вещества прореагировали полностью, то все 4 грамма кислорода ушли в продукт. Тогда масса алюминия находится через пропорцию:
выражаем m(Al):
m(Al) =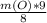 =
= 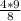 = 4,5 г
= 4,5 г