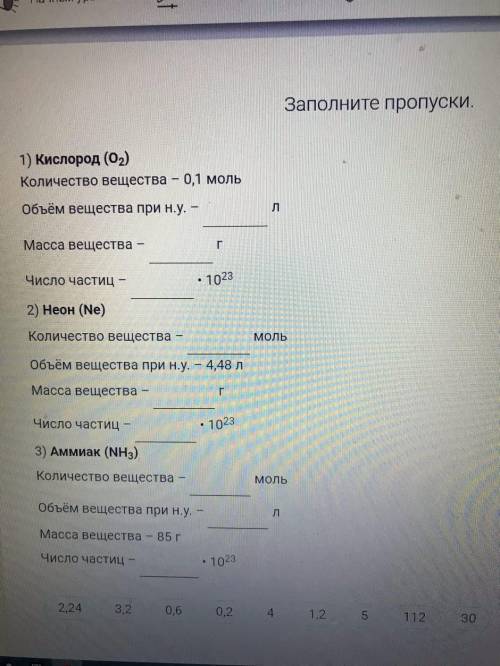
Заполните пропуски. 1) Кислород (O2)
Количество вещества – 0,1 моль
Объём вещества при н.у. – л
Масса вещества – г
Число частиц – • 1023
2) Неон (Ne)
Количество вещества – моль
Объём вещества при н.у. – 4,48 л
Масса вещества – г
Число частиц – • 1023
3) Аммиак (NH3)
Количество вещества – моль
Объём вещества при н.у. – л
Масса вещества – 85 г
Число частиц – • 1023
2,24 3,2 0,6 0,2 4 1,2 5 112 30
Другие вопросы по теме Химия
Популярные вопросы
- Во, Оленнін, қатесін тауып, көшіріп иня, Жазда суда тебеміз,күмда...
1 - Подилите число 28 в отношении 3:4 А) 10:18Б) 16:12В) 13:15 Г)...
2 - составить характеристику Ассоль по 1 главе 10 предложений повести...
3 - УМОЛЯЮ С 9-13 (4 Задачи) ТАМ НА РУССКОМ И НА КАЗАХСКОМ...
3 - Твір я ходжу в шурток арегамі...
1 - Ак Орда1 Другиенаименованиягосударства...
3 - Биография петра третьего кратко...
3 - Нехай A,B,C – три довільні події. Знайти події, які означають:...
3 - 9 класс Русский язык 3 четверть Задание с 18.01. - 22.01.21...
2 - Крестьянские выступления в период 1601-1867 года (слайд ГодыКол-во...
1
1) Кислород (O2)
Количество вещества – 0,1 моль
Объём вещества при н.у. – л
Масса вещества – г
Число частиц – • 1023
Для начала, нужно установить связь между количеством вещества и массой. Известно, что 1 моль кислорода (O2) имеет массу навскидку 32 г. Зная это, мы можем выразить массу вещества через количество вещества:
Масса = Количество вещества x Молярная масса
Масса = 0,1 моль x 32 г/моль
Масса = 3,2 г
Теперь нам нужно найти объем вещества при н.у. Так как мы знаем количество вещества и его объем, мы можем применить формулу:
Объем = Количество вещества x 22,4 л/моль
Объем = 0,1 моль x 22,4 л/моль
Объем = 2,24 л
Получаем результат:
Масса вещества – 3,2 г
Объём вещества при н.у. – 2,24 л
2) Неон (Ne)
Количество вещества – моль
Объём вещества при н.у. – 4,48 л
Масса вещества – г
Число частиц – • 1023
Здесь нам нужно найти количество вещества. Мы можем использовать формулу, обратную предыдущей:
Количество вещества = Объем / 22,4 л/моль
Количество вещества = 4,48 л / 22,4 л/моль
Количество вещества = 0,2 моль
Теперь для нахождения массы вещества мы используем ту же формулу, что в первом примере:
Масса = Количество вещества x Молярная масса
Масса = 0,2 моль x Молярная масса
У нас не указана молярная масса неона (Ne). Воспользуемся таблицей молярных масс химических элементов и найдем молярную массу неона:
M(Ne) = 20,18 г/моль
Подставляем найденные значения:
Масса = 0,2 моль x 20,18 г/моль
Масса = 4,036 г
Получаем результат:
Количество вещества – 0,2 моль
Масса вещества – 4,036 г
3) Аммиак (NH3)
Количество вещества – моль
Объём вещества при н.у. – л
Масса вещества – 85 г
Число частиц – • 1023
Здесь мы начинаем с известной массы вещества. Подобно первому примеру, мы можем использовать формулу:
Количество вещества = Масса / Молярная масса
Количество вещества = 85 г / Молярная масса
Так как мы не знаем молярную массу аммиака (NH3), воспользуемся таблицей молярных масс химических элементов и найдем молярную массу аммиака:
M(NH3) = 17 г/моль
Подставляем:
Количество вещества = 85 г / 17 г/моль
Количество вещества = 5 моль
Теперь, когда у нас есть количество вещества, мы можем использовать формулу для нахождения объема вещества:
Объем = Количество вещества x 22,4 л/моль
Объем = 5 моль x 22,4 л/моль
Объем = 112 л
Получаем результат:
Количество вещества – 5 моль
Объем вещества при н.у. – 112 л