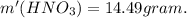Вычислите массу (г) недиссоциировавшего электролита в 2,5 л раствора азотной кислоты, если в 0,1 м растворе этой кислоты при 18˚c α = 7%.
Другие вопросы по теме Химия
Популярные вопросы
- Найди силу тока в свинцовой проволоке площадью поперечного сечения...
1 - Ch3-ch2-c=o-h - - +h2 x1-- t 140° x2 - - +cl2 x3 - - koh спирт...
3 - Образец: Нина была в Москве. Откуда она вернулась? -Она вернулась...
2 - Раставте коэффициенты в химии...
2 - придумать рассказ о путешествии на паруснике Нужно чтобы в рассказе...
1 - дан код программы а=int(input()) b=a//10 a=a%10 print (a+b)укажите...
3 - Выписать из рассказа после бала Л. Н. Толстой детали, которые...
1 - Знаю, поздно, но если есть не спящие , под ночь туплю,...
1 - Put word from brackets in appropriate form The active voice or...
2 - Розв’язати графічно рівняння. а)√х-1=0...
2
Дано:
ответ: