Вреакции разложения малахита (основной карбонат меди (ii) (cuoh)2co3 образуются три оксида. рассчитайте массу каждого оксида, образующегося при разложении 2 моль малахита. реакция: cuco3(oh)2 > 2cuo + co2+h2o получается: 1) оксид меди - cuo 2)
оксид углерода - co2 3) вода - h2o
Другие вопросы по теме Химия
Популярные вопросы
- 13(x+6)-72=123 ! и вот ещё 77+8(х-5)=125...
3 - В1000-значном числе 22446688002244668800…2244668800, вычеркнули все...
3 - Вкаком из этих слов йотированная гласная обозначает один звук: юля,...
1 - Вы пришли в магазин купить лампочки для фонарика (внутри - две батарейки...
2 - Найдите значение выражения: а) 4х − 5 при х = 1/8; б) 3х − 4у − 5...
3 - Составте предложение со словами дисциплина,коридор,облачко,парашют...
1 - Что собой представляет процесс биосинтеза...
2 - Look,read and circle the words. как это переводится ?...
2 - Что бы найти 400% от числа,нужно это число: 1)разделить на 4 2) умножить...
3 - Миша купил книгу за 170р что на 12р меньше чем заплатил петя за свою...
2
Как видно из реакции, из одного моля малахита получается два моля оксида меди (II), и по одному молю углекислого газа и воды.
Но у нас малахита два моля, поэтому умножим обе части уравнения реакции на два, получим:
Из полученного уравнения видно:
Из периодической таблицы Менделеева найдем молярные массы продуктов реакции: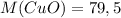 г/моль
г/моль
По формуле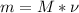 найдем массы наших оксидов.
найдем массы наших оксидов.