Весь фтороводород, полученный из 31,5 г фторида натрия, растворили в 100 г воды. Чему равна процентная концентрация полученной плавиковой кислоты?
Другие вопросы по теме Химия
Популярные вопросы
- 8 игроков среди которых четыре нападающих и четверо защитников...
2 - Каким был князь Дмитрий Иванович по отношению к Орде?Б) Какая...
1 - Чему равна сумма чисел 345,19 и 0...
3 - Поставьте глаголы в скобках в правильную форму (-ing форма (герундий))...
3 - балов. Решить задачу, составив алгебраическое выражение. На двух...
3 - которие есть умоляю англ моап впр 243 244...
1 - Что делатьесли на чужом PlayStation 4 закончились игры а новые...
3 - 1. Функция задана формулой у= - 6х+14. Определить, не выполняя...
2 - Сравните с бизнес культурой нашей страны....
3 - 1. а)° Накреслити пряму АВ. Позначити точки Mi N так, щоточка...
1
C = 13%
Объяснение:
Запишем уравнение реакции получения HF из NaF
Посчитаем кол-во в-ва NaF (оно равно массе деленной на молярную массу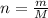 )
)
Так как кол-во в-ва NaF и HF равны, найдем массу HF (они равны, так как равны коэффициенты при формулах в уравнении реакции, это стехиометрический закон)
Процентная концентрация равна массе в-ва / массу р-ра (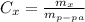 практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)
практически тоже, что и массовая доля, масса раствора равна сумме массы растворителя, в нашем случае воды (100г), и растворенного в-ва, в нашем случае плавиковой кислоты HF (15г), то есть в сумме 115г)