Составить реакцию окисления состояющая из 2 атома алюминия и 3 атомов серы. решит е , а то убьет и картошка завтра , а я не поняла тему.
Другие вопросы по теме Химия
Популярные вопросы
- 9. Укажите, что можно считать одномерным числовым массивом: 1)...
2 - Какую среднюю линейную скорость имел на орбите корабль - спутник...
1 - Комлекс упражнений для глаз должен проводиться каждыеС0-120 минут30-45...
1 - При каких значениях переменной X дробь не имеет смысла помаги...
2 - очень надо времени не так много...
3 - 1. Шедевром архитектуры древности являетсяхрам 2.Пиктограмма это3.Сколько...
1 - Требуется найти расстояние от точ. M до пр. AB. Решить надо 13,14,15,16....
2 - Ситуація із застосуванням самозахисту...
2 - Можете мені до напишіть мені Чому вчить мене Міо, мій Міо будь...
3 - Чому байка щука Глібова не втрачає актуальност ! ...
3
Запишем сначала уравнение:
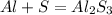
Коэффициенты в этом уравнении будут напрямую зависеть от электронов и степеней окисления атомов элментов, давайте разберем переходы электронов и изменения степеней окисления:
Рассмотрим алюминий:
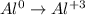
алюминий был 0 стал +3, форма записи:
среа, была 0, стала -2:
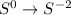
Теперь, чтоюы составить полуреаакции окисления и восстановления, нам надо разобраться с электронами:
чтобы алюминий из 0 стал +3, ему надо отдать три электрона(процесс окисление)
чтобы сера из 0 превратилась в -2, ей надо принять 2 электрона:
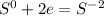
Суммируем эти два уравнения:
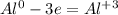
Теперь, нам надо, чтобы число отданных электронов равнялось числу принятых, для этого надо найти общее кратное у принятых и отданных электронов, у 3 и 2 - это 6, теперь, чтоюы у алюминия было 6, надо домножить на 2, а у серы надо домножить на 3, получим на выходе:
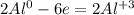 - окисление - восстановитель
- окисление - восстановитель
И записываем уравнение в молекулярном виде: