Смесь железа и оскида железа (II) обработали избытком соляной кислоты. Определите массу оскида в исходной смеси, если в ходе реакции образовалось 127г соли и выделилось 13,44л газа при (н.у)
Другие вопросы по теме Химия
Популярные вопросы
- Запишите название элементов береговой линии (заливы, проливы, острова, полуострова)...
1 - Привет всемкак дела8марта ваздровляю...
1 - складіть діалог за до цих цитат УМОЛЯЮ ...
3 - «Законы ХІІ таблиц» – А)Закрепляли разрешение на самовольный захват прибрежных...
2 - Индекс 5CH4 10NH3 3H2S 4HCI...
1 - ДЛЯ 6 КЛАССА ПО ФОРМУЛАМ ИЛИ ХОТЯ БЫ ОТВЕТЫ 1. Гранитный камень массой 3,5...
3 - за правильный ответ, и как можно скорее (((...
1 - 7. AB и CD - диаметры в окружности с центром O. Угол ABC, проведенный внутри,...
1 - На якій висоті над поверхнею землі сила тяжіння зменшується в 81 раз? Сила...
3 - А как делать жак біздін сендердін сіздердің олардың?!...
3
Дано:
Fe + FeO
HCl
m(FeCl2)=127 г
V(H2) = 13,44 л
Найти: m(FeO)-?
Запишем 2 уравнения и подпишем объем водорода в первой реакции, так как он образуется только в одной реакции
х г 13,44 л
1) Fe + 2HCl = FeCl2 + H2↑
127 г 22,4 л
(127-х)г
2) FeO + 2HCl = FeCl2 + H2O
Пусть, масса FeCl2 в первой реакции равна х г. Тогда, масса FeCl2 во второй реакции равна (127 - х) г. Подпишем это
Найдем массу FeCl2 в первой реакции
m1(FeCl2) =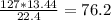 г
г
Если масса FeCl2 в первой реакции 76.2 г , то масса FeCl2 во второй реакции = 127 - 76,2 = 50,8 г
Перепишем еще раз вторую реакцию и подпишем массу FeCl2
у г 50,8 г
FeO + 2HCl = FeCl2 + H2O
72 г 127 г
Найдем массу оксида железа(II)
m(FeO) =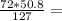 28.8 г
28.8 г
ответ: m(FeO)=28.8 г