Решить задачу: на сжигание натрия потребовалось 87 л воздуха. Вычислить массу натрия, вступившего в реакцию.
Другие вопросы по теме Химия
Популярные вопросы
- Укажіть рядок де всі сполучення слів є синтаксичними словосполученнями...
3 - 4.19. Упростите выражение:...
1 - Анализ песни Песня о россии...
1 - Is it a Fact or an Opinion? 1. Blue is the prettiest colour. 2. My...
1 - SOS Напишите кратко плюсы и минусы основных туристских макрорегионов...
2 - Решите все кроме последнего...
2 - Обозначьте хронологические рамки раннего, среднего, позднего средневековья *...
1 - Какой народ Русского Севера занимался промыслом рыбы и морского зверя...
1 - Со словами : Намысты,шамыр,жырық,кешкі,көктемгі,ұзақ,ақылды . Составить...
2 - Оцініть площу прямокутника зі сторонами a i b, якщо 4 а 7 і 12...
2
Дано:
V(воздуха) = 87л
Найти: m(Na) - ?
Для начала составим уравнение реакции горения натрия на воздухе:
ᅠᅠ
По условию объём воздуха равен 87 литрам. В воздухе содержание кислорода равно 21 проценту, следовательно найдём объём кислорода в воздухе (пусть V(воздуха) - V₁):
ᅠᅠ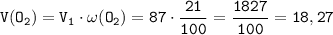 литров
литров
Перейдём к количеству вещества кислорода:
ᅠᅠ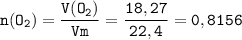 моль
моль
По уравнению реакции найдём количество вещества натрия:
ᅠᅠ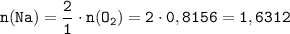 моль
моль
Зная количество вещества натрия, найдём его массу:
ᅠᅠ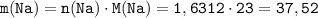 грамма
грамма
ответ: m(Na) = 37,52г.