Рассчитайте массу соли, образующейся при реакции 48г цинка с серной кислотой
Другие вопросы по теме Химия
Популярные вопросы
- На рисунке 46 изображены схемы рычагов. Какой из этих рычагов...
1 - Подъёмный кран, мощность которого 12 кВт, поднимает груз массой...
3 - С рычага показного на рисунке 52, поднят груз, на который действует...
3 - Используя подвижный и неподвижный блоки (рис. 53), груз поднимают...
3 - Мотоцикл развивает силу тяги 350 Н при скорости движения 108...
3 - На кронштейне подвешены два тела одинакового объёма (рис. 56)....
1 - Укажите на приведённых схемах рычагов (рис. 44) плечи действующих...
3 - Используя метод оценки, определите, на сколько изменилась ваша...
2 - На рисунке 55 изображён кирпич в разных положениях. Одинакова...
3 - Экспериментальное задание. Докажите, что подвижный блок даёт...
3
m(ZnSO4)=112,7 г
Объяснение:
Дано: H2O+Zn=ZnSO4+H(стрелочка вверх)
m(Zn)=48 г ν=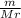
m(ZnSO4) - ? ν(Zn)=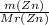 =
=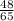 =0,7 моль
=0,7 моль
ν(ZnSO4)= 0,7 моль
m(ZnSO4)=ν(ZnSO4)×Mr(ZnSO4)=0,7 моль × 161 г/моль=121,7 г
Mr(ZnSO4)= 65+32+(4×16)= 97+64=161 г/моль