Рассчитайте массу оксида углерода,образовавшегося при прокаливании 2 тонн известняка, содержащего 12 % примесей
Другие вопросы по теме Химия
Популярные вопросы
- Как называл незконемец грех старика...
3 - Моргенштерн крутой или нет...
2 - Тест.Общая характеристика Азиатской России:Список вопросов теста Вопрос 1Сколько...
3 - аморфный кремний массой 200г сожгли в кислороде объемом 448л. вычислите массу образовавшегося...
3 - Известно, что Вычислите: а) б) в) ...
1 - Откройте файл с данной электронной таблицей(Файл прикрепила). На основании данных,...
1 - Put in Present Perfect or Past Simple. 1. Mary … (to see) already this film. She...
3 - Мини сочинение зависть и гордыня чень ...
1 - таблицы ~Невская битва~ датаместо сраженияпртивоборст.силыисход битвызначение битвы~Ледовое...
1 - Шведская модель социального государства сочетается с развитием капиталистической...
2
Дано:
m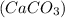 = 2 тонны =2000000 г.
= 2 тонны =2000000 г.
Wприм.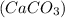 = 12%
= 12%
Найти:
m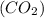 - ?
- ?
1) Wчист.в-ва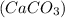 =100% - Wприм.
=100% - Wприм.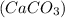 =100% - 12%=88%;
=100% - 12%=88%;
2) mчист.в-ва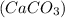 =mв-ва с прим.
=mв-ва с прим.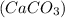 *
*
Wчист.в-ва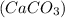 / 100%= 2000000 г. * 88% / 100%=1760000 г.;
/ 100%= 2000000 г. * 88% / 100%=1760000 г.;
3) n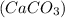 =mчист.в-ва
=mчист.в-ва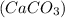 / M
/ M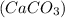 = 1760000 г. / 100 г/моль=17600 моль;
= 1760000 г. / 100 г/моль=17600 моль;
4) По уравнению реакции n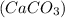 =n
=n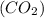 =17600 моль;
=17600 моль;
5) m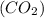 =n
=n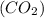 * M
* M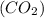 =17600 моль *
=17600 моль *
44 г/моль=774400 г. или 0.7744 тонны.
ответ: m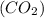 =0.7744 тонны. Всё!
=0.7744 тонны. Всё!
-------------------------------------------------------------------------------------------------
Есть вопросы? Задавай Тык